AMINES
Préparation et modes de formation des amines aliphatiques
Réaction d'Hofmann
L' alkylation de l'ammoniac par les halogénures d'alkyle en solution aqueuse ou alcoolique est la méthode proposée en 1850 par A. W. von Hofmann pour leur préparation. Cette réaction conduit à un mélange de dérivés primaires, secondaires et tertiaires, ainsi qu'à l'halogénure d'ammonium quaternaire. Ce mélange, traité par un excès de potasse, est soumis à la distillation qui permet la séparation des trois amines. Celle-ci est d'autant plus difficile que les groupes alkyle introduits sur l'azote sont plus petits :

Les proportions relatives des trois amines obtenues peuvent être modulées par l'emploi d'un excès d'ammoniac ou d'halogénure d'alkyle.
Une méthode analogue, celle de Senderens, met en œuvre l'ammoniac et un alcool que l'on fait passer sur un catalyseur comme l'alumine, à 450 0C. C'est ainsi que sont fabriquées industriellement les mono-, di- et triméthylamines. Il est possible par cette même méthode d'alkyler une amine primaire ou secondaire.
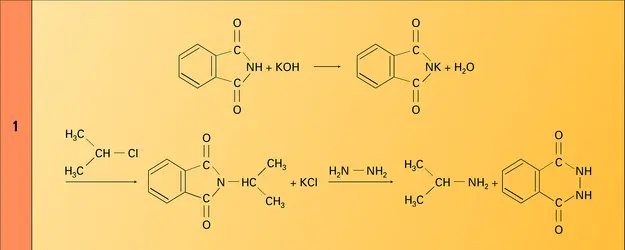
Pour éviter la complexité de la réaction d'Hofmann et aboutir à un composé unique, on a généralement recours à des méthodes de blocage. Celle de Gabriel (1887) remplace l'ammoniac par le phtalimide, qui représente un ammoniac dont deux des liaisons ont été bloquées par la fonction imide. Sa monoalkylation par un halogénure ou un sulfate d'alkyle est très facile, et le dérivé N-alkylé est soumis à une hydrazinolyse qui donne exclusivement l'amine primaire (réaction).
De même, l'alkylation du cyanate de potassium K+(N=C=O)- donne un isocyanate d'alkyle dont l'hydrolyse par la potasse concentrée, à chaud, conduit à la base primaire. C'est ainsi que Wurtz a découvert la fonction amine (1849) :

Seconde réaction d'Hofmann
La seconde réaction concerne la dégradation des amides primaires en amines primaires, proposée par Hofmann en 1881. L'amide est traité par une solution aqueuse d'hypobromite de sodium (Br2 + NaOHaq) et, par chauffage à 70 0C, il se produit un N-bromoamide, plus acide que celui de départ. La soude déprotone ce dérivé qui, perdant un ion bromure, se réarrange en isocyanate. Ce dernier, en milieu basique, élimine une molécule de CO2(CO3Na2) en formant l'amine primaire qui contient un carbone de moins que l'amide initial (réactions).
Plusieurs réactions, semblables dans leur principe, permettent de préparer les amines primaires :
– dégradation, selon Curtius, des azotures d'acyle (1894) : par chauffage en solution alcoolique, ils perdent une molécule d'azote, avec migration du groupe alkyle du carbone vers l'azote et formation d'un isocyanate, aussitôt transformé par l'alcool en uréthanne. Ce dernier est hydrolysé, en catalyse acide ou basique, en amine primaire :

– dégradation, selon Lossen, des acides hydroxamiques (1875) par déshydratation thermique en présence d'anhydride acétique : il se forme un acétate intermédiaire qui se transpose en isocyanate, hydrolysé comme dans la dégradation d'Hofmann (réaction).
Réduction de dérivés azotés
La réduction des dérivés azotés par l'étain et l'acide chlorhydrique conduit aux amines primaires.
Ces dernières sont également obtenues par l'hydrogénation catalytique des nitriles sur catalyseur de nickel à 100 0C. On les prépare enfin par réduction des imines : ces dernières résultant de l'action de l'ammoniac sur un dérivé carbonylé, ces deux composés sont soumis à l'hydrogénation :

La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. AMINES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
...formée, se condense avec deux molécules de méthanal en un composé tétracyclique, ayant une structure analogue à celle de l'adamantane, l'hexaméthylènetétramine (réaction). Les aldéhydes et les cétones réagissent de même avec les amines primaires, en donnant des imines substituées, plus stables. -
AMIDES
- Écrit par Jacques METZGER
- 1 921 mots
- 3 médias
...réalisée au moyen de l'hydrure complexe LiAlH4 (NaBH4 ne réduit pas) : on obtient les amines primaires, secondaires et tertiaires de même squelette (réactions 19). La réduction par le sodium et l'alcool (réaction de Bouveault et Blanc) conduit à un mélange d'alcool et d'amine. -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Universalis, Pierre KAMOUN
- 3 486 mots
- 6 médias
Detrès nombreuses réactions utilisent la réactivité de la fonction amine : elles sont particulièrement utilisées pour marquer les groupements NH2 terminaux des peptides ou protéines. C’est également sur des groupements NH2 que l’on peut greffer des marqueurs de nature diverse, fluorescents... -
ANILINE
- Écrit par Alain TRINQUIER
- 1 375 mots
- 2 médias
L' aniline est un composé organique renfermant une fonction amine primaire, c'est-à-dire un atome d'azote lié à un carbone et à deux hydrogènes ; l'atome de carbone appartenant à un noyau benzénique, il s'agit d'une amine aromatique, la plus simple de toutes. Elle a pour formule...
- Afficher les 13 références
Voir aussi
- BASE, chimie
- SUBSTITUTION, chimie
- SOLVATATION
- HYDROGÉNATION
- CÉTONES
- ALIPHATIQUES ou ACYCLIQUES COMPOSÉS
- ADDITION, chimie
- ALKYLATION ou ALCOYLATION
- ACYLATION
- ALDÉHYDES
- HOFMANN RÉACTION D'
- OXYDATION
- NUCLÉOPHILES SUBSTITUTIONS
- HALOGÉNATION
- GABRIEL MÉTHODE DE
- AMINES AROMATIQUES ou ARYLAMINES
- AMMONIUM QUATERNAIRE
- SENDERENS RÉACTION DE
- CHLOROFORME
- NOMENCLATURE, chimie
- RÉDUCTION, chimie
- NITREUX ACIDE
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- HALOGÉNURES D'ALKYLE
- HALOGÉNURES D'ARYLE