MAGNÉTOCHIMIE
- Article mis en ligne le
- Modifié le
- Écrit par Jean HOARAU
Radicaux libres et biradicaux
Certains composés, appelés radicaux libres, provenant le plus souvent de la dissociation de molécules organiques ou organo-métalliques comportent un nombre impair d'électrons. L'existence d'un électron non apparié conduit à un paramagnétisme de spin caractérisé par une susceptibilité molaire positive qui masque complètement le diamagnétisme :
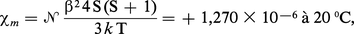
La mesure de la susceptibilité magnétique constitue une méthode de choix pour mettre en évidence ou pour doser les radicaux libres. Il suffit d'appliquer la « loi des mélanges », en tenant compte de la partie diamagnétique grâce à la loi d'additivité de Pascal. C'est ainsi que l'on a pu étudier en solution la dissociation des dérivés de l'hexaphényléthane en dérivés du radical triphénylméthyl :

Ces radicaux libres sont d'autant plus stables qu'ils correspondent à des systèmes plus conjugués, et il existe des radicaux stables à l'état pur cristallisé. C'est le cas du pentaphénylcyclopentadiényl et du diphénylpicrylhydrazyl ou D.P.P.H. qui est souvent utilisé comme étalon dans les mesures de résonance paramagnétique électronique. La mesure de la susceptibilité magnétique constitue alors un critère de pureté intéressant.
La résonance paramagnétique électronique a apporté une aide particulièrement précieuse à l'étude de ces radicaux libres, par suite de sa grande sensibilité, d'une part, et des renseignements fournis par la « structure hyperfine » de ces spectres, d'autre part. En effet, les appareils actuels permettent de détecter la présence de 1011 à 1013 centres paramagnétiques dans un volume de l'ordre de 1 cm3, soit une concentration de 10-10 à 10-8 mole par litre, ce qui dépasse largement ce que peuvent donner les mesures les plus sensibles de magnétisme statique. De plus, les interactions (ou couplages) entre le spin électronique et les spins nucléaires produisent une décomposition complexe des raies de résonance appelée structure hyperfine et caractéristique du nombre et de la nature des noyaux présents dans le radical. De façon plus précise, un radical comprenant n noyaux de spin I conduira à 2nI + 1 raies dont la position est directement liée aux constantes de couplage entre l'électron non apparié et chaque noyau, ces constantes de couplage étant elles-mêmes proportionnelles à la densité électronique correspondant à cet électron au voisinage de chacun de ces noyaux. On conçoit donc l'intérêt de ces spectres pour l'établissement des structures et l'étude de ces radicaux.
Certaines molécules présentent un paramagnétisme de spin, bien qu'elles possèdent un nombre pair d'électrons ; elles sont appelées biradicaux.
La molécule d'oxygène, qui est un des biradicaux les plus simples, contient deux électrons fortement couplés à spins parallèles. Dans les biradicaux organiques, au contraire, les deux électrons responsables du paramagnétisme ont tendance à s'éloigner au maximum l'un de l'autre ; leur couplage étant faible, il en résulte une susceptibilité paramagnétique qui est le double de celle d'un radical libre.
Les molécules diamagnétiques dans l'état fondamental se comportent dans certains états excités (états triplets) comme des biradicaux, et le phénomène de phosphorescence avait été expliqué en admettant le peuplement important de tels états sous l'action d'une lumière excitatrice. Des mesures magnétiques directes ont permis de vérifier cette hypothèse dans le cas de la fluorescéine et de nombreux composés aromatiques.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean HOARAU : professeur à l'université de Bordeaux-I, responsable de l'équipe de recherche de physicochimie théorique associée au C.N.R.S., laboratoire de chimie-physique de l'université de Bordeaux-I
Classification
Pour citer cet article
Jean HOARAU. MAGNÉTOCHIMIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
KAHN OLIVIER (1942-1999)
- Écrit par François MATHEY
- 781 mots
Chimiste français. Olivier Kahn naît à Paris en septembre 1942 dans une famille d'une grande richesse intellectuelle. Son père, Jean, était professeur et philosophe ; son frère aîné, Jean-François, est un journaliste célèbre et son frère cadet, Axel, un généticien renommé, membre correspondant de l'Académie...
-
RÉSONANCE MAGNÉTIQUE
- Écrit par Jacques COURTIEU et Maurice GOLDMAN
- 7 348 mots
- 1 média
La R.P.E. connaît quelques applications en chimie, notamment par l'étude de centres paramagnétiques appelés radicaux libres produits transitoirement au cours de certaines réactions chimiques, qui permet d'en élucider le mécanisme.




