CYCLANES & CYCLÈNES
Propriétés
Les propriétés physiques des cyclanes et des cyclènes ne présentent pas de particularités très remarquables. On notera seulement que les points de fusion et les points d'ébullition des cyclanes simples sont plus élevés que ceux des alcènes correspondants ; tous les composés des tableaux sont néanmoins liquides à la température ordinaire.
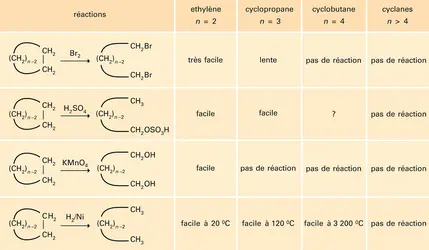
D'une façon générale, parce que ne présentant pas de point d'attaque face aux réactifs, les cyclanes comme les alcanes sont inertes dans la plupart des réactions, mis à part les cyclopropane, cyclobutane et leurs dérivés qui, par suite de la tension existant dans la molécule, ont une réactivité intermédiaire entre celle des composés saturés et celle des composés éthyléniques. Cette tension (théorie de Baeyer) apparaît claire lorsque l'on compare les chaleurs de combustion des différents cyclanes. On constate, par exemple, que la chaleur de combustion par unité CH2, qui est de 658 kJ pour les alcanes, est la même pour le cyclohexane, parce que ce dernier est sans tension sous la forme chaise qu'il adopte préférentiellement ; elle est légèrement plus grande pour le cyclopentane (762), mais nettement supérieure pour le cyclobutane (686) et le cyclopropane (696) qui sont très tendus et en réalité très proches de l' éthylène, qu'on peut considérer comme le premier terme (« cycloéthane ») de la série.
Les propriétés chimiques des cyclènes sont à peu près les mêmes que celles des alcènes ; cela est vrai au moins pour les cycles normaux (C5 à C7) et pour les grands cycles (C13 et au-dessus), avec l'avantage, pour les premiers, de conduire, par exemple dans les réactions d'addition sur la double liaison, à des composés saturés chez lesquels il n'y a pas rotation libre au niveau de la liaison simple formée, ce qui a permis la détermination aisée de la stéréochimie de nombreuses réactions d'addition sur la double liaison en général.
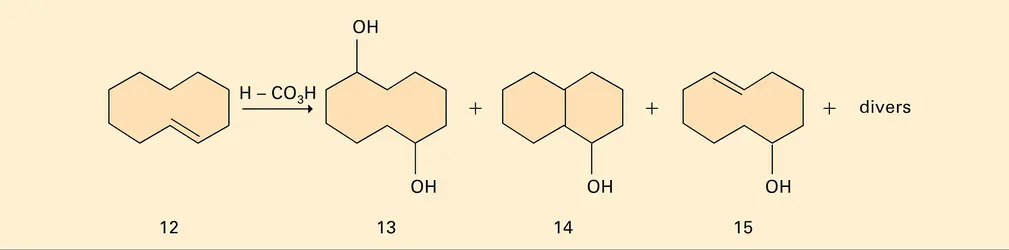
Mais c'est d'abord chez les cycles moyens (C8 à C12) que l'on rencontre des réactions particulières, notamment des réactions trans-annulaires. Ainsi, plutôt qu'au cyclodécane1,2-diol attendu, l'oxydation, par l'acide performique, du trans-cyclodécène 12 conduit, via l'époxyde, aux composés 13, 14, 15, nés de réactions où interviennent, à travers le cycle, divers hydrogènes.
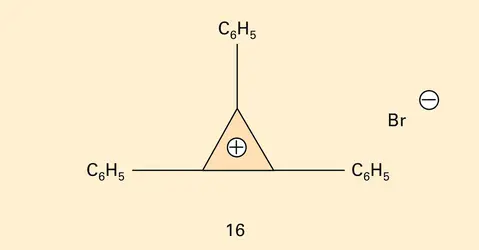
Les réactions particulières sont nombreuses chez les cyclobutènes et surtout chez les cyclopropènes, difficiles à isoler parce que fragiles, se polymérisant facilement et possédant même certaines des propriétés des acétyléniques. Par exemple, on connaît des sels de cyclopropénylium, c'est-à-dire des composés où le cycle se présente sous la forme d'un cation stable parce qu'aromatique, la charge positive étant délocalisée sur les trois carbones (16).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Marie CONIA : Professeur à la faculté des sciences de Caen
Classification
Pour citer cet article
Jean-Marie CONIA. CYCLANES & CYCLÈNES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
CONFORMATIONS, chimie
- Écrit par Jacques GORÉ
- 3 324 mots
- 5 médias
Du fait de leur plus grand nombre de carbones, ces cyclanes sont plus flexibles que le cyclohexane et, généralement, le nombre de conformations stables est supérieur à deux. Pour le cycloheptane, il existe à côté des formes chaise et bateau, voisines de celles du cyclohexane, une forme croisée... -
CYCLOPENTADIÈNE
- Écrit par Dina SURDIN
- 327 mots
Cyclène de formule :

Masse moléculaire : 66,10 g
Masse spécifique : 0,8047 g/cm3
Point de fusion : —85 0C
Point d'ébullition : 42 0C
Liquide incolore.
Insoluble dans l'eau ; soluble dans le sulfure de carbone, l'aniline, l'acide acétique. Miscible à l'éthanol, à l'éther, au benzène et...
-
HYDROCARBURES
- Écrit par Pierre LASZLO
- 4 523 mots
- 4 médias
Les hydrocarbures cycliques, à commencer par les cyclanes ou cycloalcanes, ont des tensions de cycle, dénommées tension de Baeyer, du nom du chimiste allemand Adolf von Baeyer (1835-1917) qui le premier les signala. Le cyclopropane C3H6 en est un exemple (fig. 1). Le cycle y a la forme d'un triangle... -
PÉTROLE - Le pétrole brut
- Écrit par Bernard TISSOT
- 3 439 mots
- 6 médias
Les cyclanes sont en quantité assez variable : parmi eux les molécules tétracycliques et pentacycliques sont responsables de l'activité optique des hydrocarbures saturés (stéranes, triterpanes ; ).
Voir aussi
- CIS CONFIGURATION
- TRANS CONFIGURATION
- ÉTHYLÈNE
- CYCLO-ADDITION
- DIELS-ADLER RÉACTION DE
- CYCLIQUES COMPOSÉS
- SIMPLE LIAISON
- HYDROGÉNATION
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- CHAISE CONFORMATION
- CYCLOBUTANE
- CYCLOPENTANE
- CYCLOPROPÈNE
- CYCLOBUTÈNE
- CYCLOHÉXÈNE
- CYCLOPROPANE
- BAEYER TENSION DE
- NOMENCLATURE, chimie
- STÉRÉO-ISOMÉRIE