FER Rôle biologique du fer
Le fer est nécessaire à toute forme de vie sur Terre (seules quelques rares bactéries peuvent utiliser le manganèse à la place du fer) du fait de ses propriétés de fixation d'oxygène et d'oxydo-réduction. Cette capacité à réagir avec l'oxygène, qui le place aussi au centre des situations de stress oxydatif, le rend particulièrement dangereux pour les constituants cellulaires lorsqu'il n'est pas parfaitement pris en charge ou lorsqu'il est présent en excès.
Le fer est utilisé dans les organismes vivants essentiellement pour assurer le transport d'oxygène, ou catalyser des réactions de transfert d'électrons, de fixation d'azote ou de synthèse d'ADN. En solution, le fer peut exister sous deux états d'oxydation, le fer ferreux Fe (II) et le fer ferrique Fe (III). Il est faiblement soluble au pH physiologique, particulièrement quand il est sous la forme oxydée de Fe (III), et pour éviter qu'il ne précipite, les organismes vivants fabriquent de nombreuses protéines qui servent à le transporter ou à le stocker dans les cellules.
Rôles et fonctions physiologiques du fer dans le monde du vivant
Les protéines du métabolisme du fer
Dans le métabolisme du fer, deux grandes classes de protéines différentes interviennent. D'une part, celles qui sont nécessaires au transport du fer (sidérophores) dans les fluides biologiques, à son passage à travers les membranes cellulaires, à son stockage dans les tissus sous une forme facilement disponible et non toxique, mais aussi les protéines à activité ferroxydase ou ferriréductase, qui catalysent les nombreux passages de l'état ferreux à l'état ferrique, ou réciproquement, que subit ce métal dans un organisme vivant. Ces protéines, dont la plupart ont été découvertes depuis la fin des années 1990, seront présentées dans leur contexte par les chapitres suivants.
D'autre part, celles qui dans l'organisme utilisent le fer pour leur fonction ; ces protéines peuvent être distinguées d'après le degré de coordination de l'atome de fer dans la molécule, en corrélation avec la grande variété de fonctions auxquelles le fer est associé.
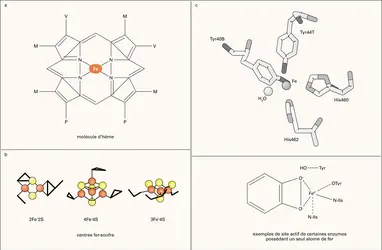
Chez les hémoprotéines, le fer est présent sous forme d'hème, lié aux quatre noyaux pyrroles d'une molécule de porphyrine IX (fig. 1a). L'hème est le groupement prosthétique de protéines de transport d'oxygène (hémoglobine, myoglobine), d'activateurs de l'oxygène moléculaire (cytochrome P450, cytochromes oxydase, peroxydase, catalase) ou de transport d'électrons (cytochrome de la chaîne respiratoire mitochondriale). Une deuxième classe de protéines à fer est constituée par les protéines à centre fer-soufre (fig. 1e), où des atomes de fer sont liés de façon covalente à des atomes de soufre, et ces structures, de composition variable de type [2Fe-2S], [3Fe-4S] ou [4Fe-4S], sont liées à la protéine par l'intermédiaire de résidus cystéine.
La troisième classe contient des protéines où le fer est présent sous forme d'un seul atome associé à des acides aminés particuliers (le plus souvent une histidine ou une cystéine) du site actif de la molécule (fig. 1c), avec une organisation du site de coordination très variable suivant les enzymes qui en sont porteuses.
Le fer dans l'évolution
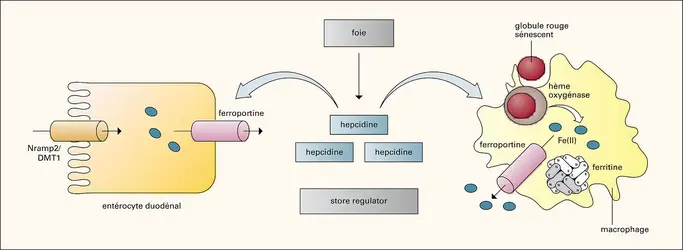
À l'inverse de la ferritine, la protéine de stockage du fer, qui est évolutivement très conservée, les systèmes d'acquisition du fer ont considérablement évolué entre les espèces et se sont adaptés à la forme chimique sous laquelle le fer se trouve dans l'environnement. Les bactéries sont capables, suivant les cas, de transporter des complexes de fer-citrate ou de synthétiser des molécules de sidérophores qui chélatent le fer dans le milieu environnant pour l'importer dans la bactérie. Pour les bactéries pathogènes ou commensales, l'hème représente une[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Carole BEAUMONT : directeur de recherche à l'I.N.S.E.R.M.
Classification
Pour citer cet article
Carole BEAUMONT. FER - Rôle biologique du fer [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
APPARITION DE L'INDUSTRIE DU FER
- Écrit par Nicole CHÉZEAU
- 183 mots
Les premières traces de l'industrie du fer sont attestées vers 1700 à 1500 avant J.-C. dans le sud du Caucase. À cette époque, les forgerons chalybes faisaient chauffer un mélange de minerai de fer et de charbon de bois dans un simple trou. Chez les Hittites, ce procédé primitif évolue vers le...
-
FER, FONTE ET ACIER - (repères chronologiques)
- Écrit par Olivier LAVOISY
- 582 mots
— 1700-— 1500 Début de l'industrie du fer avec les premières traces, au Sud du Caucase, de foyers permettant la réduction (élimination d'oxygène) de minerais de fer au charbon de bois.
Vers — 1250 Une lettre du roi hittite Hattusil III mentionne une épée en fer.
— 1100-— 800...
-
ACIER - Technologie
- Écrit par Louis COLOMBIER, Gérard FESSIER, Guy HENRY, Joëlle PONTET
- 14 176 mots
- 10 médias
Rappelons que le fer existe sous deux variétés allotropiques différentes, c'est-à-dire avec deux formes cristallines. -
AIMANTS
- Écrit par Roger FONTAINE
- 6 273 mots
- 13 médias
-
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
...mis en œuvre pour des usages tels que les pièces soumises aux plus gros efforts dans les trains d'atterrissage des avions (cf. acier – Technologie). L'acier le plus simple est un alliage de fer et de carbone, renfermant moins de 2 p. 100 en poids de carbone (9 atomes pour 100). Il faut rappeler que... -
APPARITION DES HAUTS-FOURNEAUX
- Écrit par Olivier LAVOISY
- 222 mots
En Occident, les premiers hauts-fourneaux apparaissent vraisemblablement dans la région de Liège durant la seconde moitié du xive siècle. Le principe est d'augmenter la taille des foyers pour accroître la production de fer. Cependant la réduction (élimination de l'oxygène) de minerais de fer...
- Afficher les 55 références
Voir aussi
- DUODÉNUM
- VILLOSITÉS INTESTINALES
- TRANSPORTS MEMBRANAIRES
- RÉGULATION MÉTABOLIQUE
- HÉRÉDITAIRES MALADIES ou MALADIES GÉNÉTIQUES
- PROTÉINES FER-SOUFRE
- ARN MESSAGER ou ARNm
- ÉRYTHROPOÏÉTINE (EPO)
- TRANSFERRINE ou SIDÉROPHILINE
- PLASMA SANGUIN
- PHYSIOLOGIE
- HÈME
- HÉMOPROTÉINES
- ABSORPTION INTESTINALE
- HEPCIDINE
- RÉDUCTASES
- FERROPORTINE
- RÉGULATION BIOLOGIQUE
- CÉRULOPLASMINE
- HÉMATIE ou GLOBULE ROUGE ou ÉRYTHROCYTE
- ÉRYTHROPOÏÈSE
- HÉPHAESTINE
- HÉMOJUVÉLINE
- NUTRITION HUMAINE
- FER MÉTABOLISME DU
- FERRITINE
- PROTÉINES
- RÉCEPTEURS MEMBRANAIRES
- ALIMENTATION, physiologie humaine