DYNAMIQUE MOLÉCULAIRE
- 1. Une nouvelle composante de la connaissance des structures des molécules
- 2. Notions de structure en solution
- 3. Une méthode privilégiée pour l'étude de la dynamique moléculaire : la résonance magnétique nucléaire
- 4. Libre rotation autour d'une liaison
- 5. La pyramide trigonale
- 6. L'inversion du tétraèdre
- 7. La pseudorotation des coordinats autour d'un élément pentacoordiné
- 8. Complexes octaédriques
- 9. Nombres de coordination plus élevés
- 10. Les composés organométalliques : des structures très turbulentes
- 11. Macromolécules et biopolymères
- 12. Bibliographie
La pseudorotation des coordinats autour d'un élément pentacoordiné
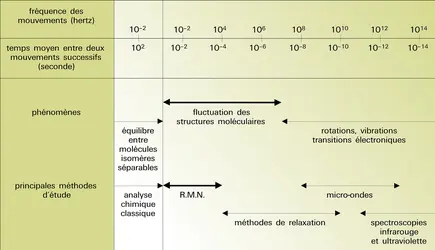
Les molécules dans lesquelles un élément central porte cinq substituants sont de plus en plus fréquemment rencontrées, en particulier dans la chimie du phosphore, mais également dans celle des métaux de transition. La pentacoordination est également importante dans la mesure où on la trouve impliquée dans de nombreux états de transition et intermédiaires au cours des réactions chimiques (addition transitoire d'un cinquième substituant sur un atome tétracoordiné, ou départ de l'un des substituants d'un atome initialement hexacoordiné). La fluctuation rapide des structures moléculaires y est la règle.
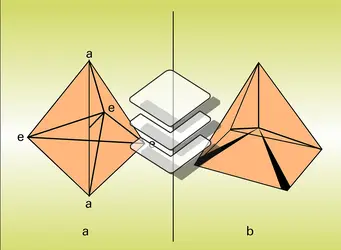
Il existe essentiellement deux manières d'ordonner régulièrement cinq substituants autour d'un atome : aux cinq sommets, soit d'une bipyramide trigonale (structure a), soit d'une pyramide à base carrée (structure b), centrées sur cet atome. La première est le plus fréquemment rencontrée dans l'état fondamental, c'est-à-dire lorsque les molécules sont au repos à basse température. Elle se caractérise par deux types de sites (ou sommets) distincts, les sites équatoriaux (e) disposés à 1200 l'un de l'autre dans un plan contenant l'atome central, et les sites apicaux (a) situés sur un axe perpendiculaire à ce plan. Mais les barrières d'énergie qui s'opposent au passage des substituants de l'un à l'autre de ces sites sont souvent faibles, de sorte que l'échange des substituants entre sites, qui peut donner naissance à de nouvelles molécules, isomères des molécules initiales si les substituants sont différents (par exemple, les structures c, d et e), est souvent très rapide dès la température ambiante.
L'existence de ces échanges rapides se traduit dans les spectres de R.M.N. par la présence d'un signal seulement pour les cinq substituants dans les molécules PF5, Fe(CO)5 ou encore Rh[P(OCH3)]5, bien que la structure en bipyramide trigonale ait pu être établie sans ambiguïté par spectrométrie infrarouge, diffraction électronique, etc., et que l'on attendrait donc deux signaux en R.M.N. si la molécule était figée, l'un pour les substituants en position apicale, l'autre pour ceux qui occupent les sites équatoriaux. Il doit donc exister un ou plusieurs mécanismes qui permettent l'échange rapide des substituants entre sites apicaux et équatoriaux. Cela est confirmé par le dédoublement des signaux généralement observé lorsque les mesures spectrales sont réalisées à basse température, c'est-à-dire dans des conditions où les processus d'échange sont considérablement ralentis.
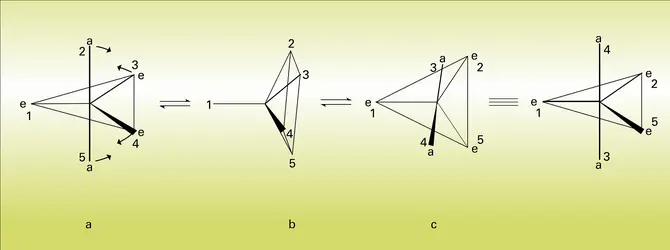
Le mécanisme le plus généralement invoqué pour ces échanges est la « pseudorotation », dans laquelle on assiste à une augmentation de l'angle formé par deux des liaisons équatoriales et à la diminution simultanée de l'angle formé par les liaisons apicales (9 a). Durant ce mouvement, ces deux paires de liaisons restent dans des plans mutuellement perpendiculaires dont l'intersection porte la cinquième liaison, qui joue un rôle de « pivot » au cours de la pseudorotation. Une configuration intermédiaire en forme de pyramide à base carrée est atteinte lorsque les deux angles déformés deviennent égaux (9 b). Si le mouvement se poursuit, les substituants initialement situés en position apicale finissent par occuper les positions équatoriales et vice versa (9 c).
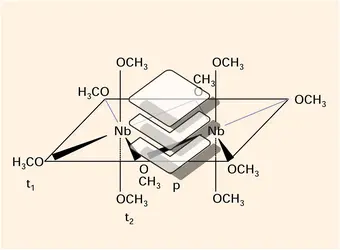
L'existence de plusieurs isomères en interconversion rapide a parfois été reconnue. Dans l'exemple des composés 8 c, d et e, les deux isomères identifiés dans la solution, 8 c et d, sont différents de celui qui a été trouvé dans la phase solide, 8 e. On conçoit également l'importance déterminante que peuvent avoir ces phénomènes d'échange sur les produits d'une réaction, lorsqu'un intermédiaire[...]
- 1. Une nouvelle composante de la connaissance des structures des molécules
- 2. Notions de structure en solution
- 3. Une méthode privilégiée pour l'étude de la dynamique moléculaire : la résonance magnétique nucléaire
- 4. Libre rotation autour d'une liaison
- 5. La pyramide trigonale
- 6. L'inversion du tétraèdre
- 7. La pseudorotation des coordinats autour d'un élément pentacoordiné
- 8. Complexes octaédriques
- 9. Nombres de coordination plus élevés
- 10. Les composés organométalliques : des structures très turbulentes
- 11. Macromolécules et biopolymères
- 12. Bibliographie
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean RIESS : professeur à l'université de Nice-Sophia Antipolis, directeur de l'unité de chimie moléculaire associée au C.N.R.S.
Classification
Pour citer cet article
Jean RIESS. DYNAMIQUE MOLÉCULAIRE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
BIOPHYSIQUE
- Écrit par Claude Michel GARY-BOBO
- 6 413 mots
...modernes permettent de traiter d'importants ensembles d'informations de ce type. La difficulté provient du fait, rapidement reconnu par cette approche, qu'une molécule, même lorsqu'elle n'est pas très grande, ne se trouve pas sous une forme ou configuration unique, mais qu'elle oscille sans cesse entre... -
CRISTAUX LIQUIDES
- Écrit par Henry GASPAROUX
- 4 816 mots
- 9 médias
...à des bâtonnets cylindriques ou à des ellipsoïdes. Ces modèles ont conduit à une bonne description des propriétés des phases smectiques et nématiques. On essaie actuellement, à l'aide des techniques spectroscopiques habituelles, de dépasser et d'affiner ce type de description afin de savoir quelle est... -
MOLÉCULE
- Écrit par André JULG
- 4 301 mots
Si l'hypersurface présente plusieurs minimums énergétiquement bien séparés, à chacun d'eux correspond une molécule. Les diverses molécules ainsi définies possèdent la même formule brute et sont dites isomères. La série des sucres nous offre de très nombreux cas d'isomérie. Par... -
TAUTOMÉRIE
- Écrit par Bernard CARTON
- 137 mots
Cas particulier de transposition intramoléculaire, résultant de réarrangements rapides et réversibles (isomérie dynamique). Plus précisément, on appelle ainsi la transformation d'un corps chimique en un isomère différent du premier par l'emplacement d'un atome et par la disposition des liaisons, cette...
Voir aussi
- FRÉQUENCE, physique
- SPECTROCHIMIQUE ANALYSE
- ÉTHYLÈNE
- PIC, chimie analytique
- SITE DE FIXATION
- ÉNERGIE D'ACTIVATION
- RMN (résonance magnétique nucléaire), physico-chimie
- SUBSTITUTION, chimie
- ORBITALES MOLÉCULAIRES
- LIBRE ROTATION, chimie
- CRISTALLOCHIMIE
- TÉTRAÈDRE, stéréochimie
- OCTAÈDRE, stéréochimie
- SOLUTION, chimie
- PROTÉINES
- COORDINATION COMPOSÉS DE