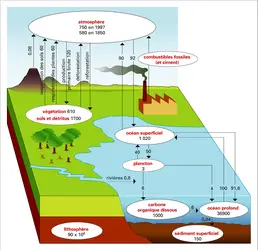
CYCLES BIOGÉOCHIMIQUES
Le soufre
À l'état réduit, le soufre (S) est un élément indispensable à la vie. À l'état oxydé de sulfate, il constitue le deuxième anion par ordre d'abondance dans les rivières et l'océan (après l'ion chlorure). Son cycle naturel est profondément perturbé, parce que les combustions de charbons et de certains pétroles sont responsables d'émissions de soufre comparables aux flux naturels. Il n'est donc plus possible d'étudier ce cycle biogéochimique sans prendre en compte le rôle des activités humaines.
Différentes formes chimiques
Le soufre existe sous plusieurs états d'oxydation et participe à de nombreuses réactions d'oxydoréduction. L'état le plus réduit, S(–2) est représenté par des composés comme H2S, RSH (où R représente une chaîne organique), RSR, OCS, CS2, CuS2, HgS. À l'exception de H2S, ces espèces ne s'oxydent que lentement. Seules les eaux anoxiques (marécages, eaux interstitielles des sédiments) peuvent être une source de H2S pour l'atmosphère. L'état S(–1) correspond à des composés comme RSSR ou FeS2. Les deux formes de soufre réduit constituent les sulfures d'un grand nombre de métaux (Ag, Fe, Cd, Mn, Hg, Ca, Te, Se, As, Sn, Cu, Pb, Pt, Co, Ni, Mo). Elles existent aussi dans des composés organiques, comme les acides aminés (cystéine, méthionine). Par des liaisons disulfures (–SS–), le soufre assure les liens entre les acides aminés des protéines. La quantité de soufre contenue dans les organismes, tout comme celle de phosphore, est faible (environ 0,25 p. 100 du poids sec).
La forme la plus oxydée du soufre est S(+6) de l'ion sulfate. Elle est présente dans l'atmosphère (acide sulfurique, sulfate d'ammonium) et dans l'océan. L'évaporation de l'eau de mer dans des bassins fermés conduit à des dépôts dans lesquels le soufre est à l'état de sulfate de calcium (gypse ou anhydrite).
L'état intermédiaire S(+4) a seulement une existence transitoire. On le trouve sous forme de gaz sulfureux SO2 dans l'atmosphère, les gaz volcaniques et les émissions industrielles. SO2 est soluble dans l'eau, donnant naissance à des ions HSO3— et SO3–– instables, qui s'oxydent en SO4––. Dans l'air, SO2 est oxydé en sulfate par les radicaux OH.
Le soufre à l'état élémentaire est formé naturellement par des processus bactériens ou inorganiques. Dans tous les cas, c'est un composé à degré d'oxydation S(+6) qui réagit avec un sulfure S(–2) pour donner du soufre S(0).
La phase atmosphérique du cycle du soufre
Les processus biologiques sont responsables de la production d'une grande variété de composés gazeux. Les écosystèmes terrestres émettent H2S, CS2, COS (sulfure de carbonyle), CH3SH (méthyl mercaptan), CH3SCH3 (DMS, sulfure de diméthyl), CH3SSCH3 (disulfure de diméthyl). Le DMS est le principal responsable des émissions de sulfure en océan ouvert. Il s'oxyde essentiellement en très fines particules de sulfates, qui servent de noyaux de condensation pour les nuages en atmosphère marine. Ces aérosols retombent avec les pluies ou sous forme de dépôt sec.
Les activités industrielles, les feux de biomasse et les volcans émettent principalement du gaz sulfureux SO2. Les volcans constituent une source mineure pour la basse atmosphère, mais une source épisodique majeure pour la stratosphère, où le SO2 est oxydé en aérosols d'acide sulfurique qui interceptent le rayonnement solaire et contribuent à refroidir la basse atmosphère pendant environ deux ans, jusqu'à ce que la stratosphère ait été nettoyée. Les feux de biomasse naturels et anthropiques sont aussi responsables d'émissions d'aérosols soufrés et carbonés, d'où un lien entre les deux cycles. En quelques jours, l'ensemble des composés soufrés atmosphériques est oxydé en sulfates. Ceux-ci sont lessivés[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Claude DUPLESSY : directeur de recherche au C.N.R.S., Centre des faibles radioactivités, Gif-sur-Yvette
Classification
Pour citer cet article
Jean-Claude DUPLESSY. CYCLES BIOGÉOCHIMIQUES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
BACTÉRIES
- Écrit par Jean-Michel ALONSO, Jacques BEJOT, Patrick FORTERRE
- 11 052 mots
- 3 médias
Tous les éléments constitutifs de la matière vivante subissent une transformation cyclique, passant sans cesse de l'état minéral à l'état organique et vice versa. Grâce à l'énergie solaire, les plantes vertes, par assimilation chlorophyllienne, procèdent à « l'organisation » de la matière, autrement... -
BIOSPHÈRE
- Écrit par Paul DUVIGNEAUD, Maxime LAMOTTE, François RAMADE
- 3 431 mots
- 5 médias
...hydrogène – peuvent être suivis et dosés dans le milieu ambiant, en dehors des organismes vivants. Ainsi peuvent être définis ce que l'on appelle des cycles biogéochimiques et par là précisées, à la fois qualitativement et quantitativement, les modalités du fonctionnement de la biosphère comme celles... -
ENVIRONNEMENT - Un enjeu planétaire
- Écrit par Jean-Paul DELÉAGE
- 2 014 mots
- 1 média
...terrestre, désastre que les biologistes désignent comme « la sixième extinction en masse » depuis l'apparition de la vie sur Terre. Elle bouleverse ainsi les cycles biogéochimiques avec l'entrée dans l'ère de l'« Anthropocène ». Paul J. Crutzen et Eugene F. Stoermer ont ainsi désigné (2000) l'époque géologique... -
MILIEU, écologie
- Écrit par Cesare F. SACCHI
- 7 829 mots
- 1 média
...indispensables à la vie des végétaux autotrophes, puis à celle des animaux puisqu'ils sont la source des éléments biogènes fondamentaux, phosphore et azote. Le cycle biogéochimique de l'azote est complexe, entraînant des réactions multiples d'oxydation et de réduction, car il fait partie des protides à l'état... - Afficher les 7 références
Voir aussi
- ANHYDRIDE SULFUREUX ou DIOXYDE DE SOUFRE
- TOXICITÉ
- SULFURES
- NITRATATION
- INDUSTRIELLE SOCIÉTÉ
- ÉQUILIBRES NATURELS
- GISEMENTS MÉTALLIFÈRES
- PLUIE
- EAU CYCLE DE L' ou CYCLE HYDROLOGIQUE
- ÉROSION & SÉDIMENTATION
- OXYDORÉDUCTION
- BIOMASSE
- VÉGÉTALE BIOLOGIE
- ORGANOMERCURIELS COMPOSÉS
- PHOSPHATES SÉDIMENTAIRES
- PHYTOPLANCTON
- ÉVAPORITES
- ÉLÉMENTS CHIMIQUES
- PHOSPHATES
- PROFONDEURS OCÉANIQUES, biologie
- OXYDES D'AZOTE
- AZOTE ORGANIQUE
- ÉROSION & SÉDIMENTATION CONTINENTALES
- EAU DE MER
- CARBONE CYCLE DU
- UPWELLING, océanographie
- AZOTE ATMOSPHÉRIQUE
- PHOSPHOLIPIDES
- CROÛTE TERRESTRE ou ÉCORCE TERRESTRE
- SOUFRE CYCLE DU
- AZOTE CYCLE DE L'
- DÉCOMPOSEURS, écologie
- PRODUCTION, écologie
- RESPIRATION
- ATMOSPHÈRE, chimie
- NITRIFICATION
- AÉROSOLS
- EFFET DE SERRE
- OXYGÈNE CYCLE DE L'
- PHOSPHORE CYCLE DU
- NITRATES
- ANTHROPISATION
- RÉSEAUX TROPHIQUES ou CHAÎNES ALIMENTAIRES, écologie
- PLUIES ACIDES
- VOLCANS
- ASSIMILATION, physiologie
- ÉROSION
- CROISSANCE DÉMOGRAPHIQUE
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE