CHLORURE D'HYDROGÈNE
Formule brute : HCl
Masse moléculaire : 36,46 g
Point d'ébullition : — 84,9 0C
Point de fusion : — 114 0C
Température critique : 51,54 0C.
Gaz incolore d'odeur forte et étouffante, très soluble dans l'eau (qui à la température ordinaire en dissout environ 450 fois son volume), fumant dans l'air humide, corrosif.
On appelle acide chlorhydrique (esprit de sel, acide muriatique) les solutions aqueuses de HCl.
Les solutions aqueuses de chlorure d'hydrogène sont très corrosives et sont stockées dans des récipients en céramique, en verre ou en matières plastiques résistant aux acides. La solution commerciale (comportant de 28 à 35 p. 100 en poids de HCl) titre de 18 à 22 0Bé et se vend sous le nom d'acide chlorhydrique concentré. On trouve aussi le composé liquide sous forme anhydre malcommode et d'un usage limité (il nécessite un stockage en récipients lourds et coûteux). C'est un acide très fort dont les solutions aqueuses sont fortement dissociées ; la dissociation est totale en solution diluée.
Le chlorure d'hydrogène gazeux réagit à température relativement élevée avec les métaux et leurs oxydes, hydroxydes ou carbonates pour donner les chlorures correspondants.
Très inerte quand il est parfaitement débarrassé d'humidité, il réagit fortement en présence d'eau.
Ses réactions sont celles des acides forts habituels : action sur les métaux avec dégagement d'hydrogène, réactions avec les oxydes, neutralisation des bases avec formation d'eau et de sel : HCl + NaOH donnent NaCl + H2O ;
il déplace enfin les acides plus faibles de leurs composés. Il entre dans toutes les réactions caractéristiques de l'ion Cl— des composés minéraux et c'est un puissant agent chlorurant des composés organiques. Avec certains métaux il forme des ions complexes (comme, par exemple, PtCl6—, CuCl4—, ...) ce qui explique la facilité avec laquelle il dissout certains métaux et oxydes métallurgiques, qui résistent ou sont faiblement attaqués par l'acide sulfurique ou l'acide nitrique.
Mélangé avec de l'acide nitrique (eau régale), il attaque même l'or, avec formation de sels complexes, et le platine.
Le chlorure d'hydrogène se prépare par action directe du chlore sur l'hydrogène à chaud (250 0C) : Cl2 + H2 donnent 2 HCl + 22 kcal/mole,
réaction qui est accélérée en présence d'humidité. Elle s'effectue aussi par inflammation directe des deux gaz au chalumeau.
chalumeau.
La méthode usuelle de préparation, aussi bien en laboratoire qu'industriellement, est son déplacement direct par l'acide sulfurique :2 NaCl + H2SO4donnent Na2SO4 + 2 HCl.
On l'obtient aussi par hydrolyse de certains chlorures (MgCl2 ou PCl3) ou comme sous-produit dans la chloruration de nombreux produits organiques (méthane, benzène...).
Les utilisations de l'acide chlorhydrique découlent de ses propriétés chimiques. C'est un réactif très couramment employé en laboratoire ; il sert à la préparation des chlorures métalliques, de l'hydrogène sulfuré, et trouve un emploi constant en volumétrie (titration des solutions basiques), le plus souvent en solution décinormale. L'industrie en consomme de grandes quantités pour le traitement des métaux et la concentration de certains minerais.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Pour citer cet article
Encyclopædia Universalis. CHLORURE D'HYDROGÈNE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Autres références
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
Enfin, parmi d'autres réactions, on retiendra la formation de chlorure d'hydrogène par une réaction avec le méthane, CH4, ou l'hydrogène moléculaire, H2 ou d'autres constituants comme le formaldehyde, H2CO, le peroxyde d'hydrogène, H2O2. On observe par exemple la réaction :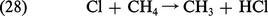
-
HALOGÈNES
- Écrit par Jacques METZGER et Robert de PAPE
- 6 600 mots
- 5 médias
...comparaison des conditions de réaction permet d'apprécier les réactivités des halogènes : spontanée et explosive avec le fluor, même aux basses températures, elle doit être amorcée dans le cas du chlore, par exemple à l'aide d'un rayonnement ultraviolet ; avec le brome elle devient plus difficile et nécessite...



