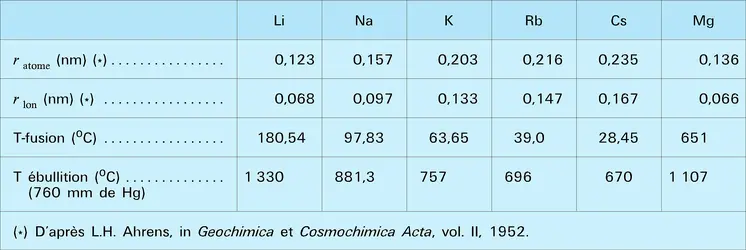
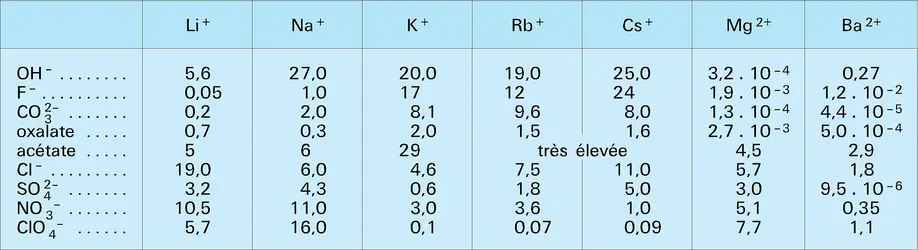
LITHIUM
Applications
Le lithium intervient largement dans la fabrication de batteries du fait de son grand potentiel électrochimique. C’est le cas notamment des batteries embarquées, de celles qui équipent les ordinateurs portables à celles de sondes et satellites, car elles sont peu volumineuses et ont une grande densité énergétique aussi bien que massique.
Le lithium est aussi présent dans certains médicaments, pour le traitement de troubles neurologiques, dermatologiques, de la sclérose latérale amyotrophique… Il est également utilisé pour durcir certains alliages de plomb, des céramiques devant résister aux chocs, dans la fabrication de verres et de céramiques à faible expansion thermique (optique) ou soumis à des rayons X avec lesquels le lithium interagit peu (matériel de mesure physique). Enfin, parmi de nombreuses autres applications secondaires, le lithium permet, par réaction nucléaire, de produire du tritium, élément utilisé pour les expériences sur la fusion thermonucléaire.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Roger NASLAIN : docteur ès sciences, ingénieur chimiste, professeur à l'université de Bordeaux-I
- Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Pour citer cet article
Universalis et Roger NASLAIN. LITHIUM [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ATOME
- Écrit par José LEITE LOPES
- 9 140 mots
- 13 médias
L'atome de lithium contient trois électrons qui se meuvent autour d'un noyau à trois charges positives. Deux de ces électrons forment une configuration analogue à celle de l'atome d'hélium. Selon le principe de Pauli, le troisième électron ne pourra pas avoir son nombre quantique principal ... -
GOODENOUGH JOHN B. (1922-2023)
- Écrit par Bernard PIRE
- 1 163 mots
- 1 média
...d’Oxford (Royaume-Uni) pour diriger un laboratoire de chimie inorganique. Le chimiste Stanley Whittingham (né en 1941) développe alors les premières batteries au lithium ionique rechargeables pour le compte du centre de recherche de la compagnie Exxon, à Linden (New Jersey, États-Unis). Celles-ci sont... -
MÉTAUX - Métaux alcalins
- Écrit par Jean PERROTEY
- 3 023 mots
- 4 médias
-
MÉTAUX RARES
- Écrit par Christian HOCQUARD
- 6 441 mots
- 7 médias
La demande en carbonate de lithium va croître rapidement avec la commercialisation massive d'automobiles électriques à batteries lithium-ion (Li-ion). Différentes utilisations sont également attendues dans d'autres secteurs : nouveaux alliages aluminium-lithium destinés à l'industrie aérospatiale ; la... - Afficher les 12 références
Voir aussi