NITRIQUE ACIDE
- Article mis en ligne le
- Modifié le
- Écrit par Jean ROUXEL
Propriétés chimiques de l'acide nitrique
Les propriétés chimiques peuvent se classer en trois groupes : HNO3 est un acide fort, c'est un oxydant et un agent de nitration.
Les propriétés acides se trouvent directement illustrées par l'équilibre de dissociation en milieu dilué (réaction 4). Toutefois, si de l'acide pur est ajouté à un autre acide, il se comportera comme un donneur protonique si ce second acide est le plus faible, mais pourra au contraire jouer le rôle d'accepteur protonique dans l'hypothèse inverse (réaction 5).
Les propriétés oxydantes peuvent être illustrées par l'action de l'acide nitrique sur les métaux. Tous ne réagissent pas : le comportement possible peut être dégagé des deux schémas suivants (réactions 6).
Tout métal dont le potentiel normal d'oxydoréduction est supérieur à 0,96 V ne peut être oxydé. Il en est ainsi de l'or (Eo = 1,38 V) et du platine (Eo = 1,60 V).
Tout métal dont le potentiel d'oxydo-réduction est compris entre 0,80 et 0,96 V est oxydé, le gaz dégagé contient de l'oxyde azotique NO, incolore ; c'est le cas du mercure (Eo = 0,86 V).
Tout métal, enfin, dont le potentiel d'oxydoréduction est inférieur à 0,80 V est oxydé selon les deux réactions simultanément possibles, et avec dégagement d'un mélange NO — NO2 (vapeurs nitreuses) de composition variable selon le métal et la concentration de l'acide.
Les réactions de nitration mettent en jeu l'ion NO2+ résultant du processus d'ionisation HNO3 en milieu acide fort. L'exemple le plus classique concerne l'obtention de nitrobenzène par action d'un mélange sulfonitrique sur le benzène selon le processus :
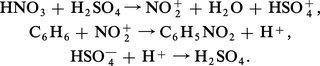
Cette réaction, fortement exothermique, doit être contrôlée par refroidissement à 0 0C du système réactionnel.
Les dérivés nitrés sont très importants, citons :
C6H5NO2, nitrobenzène, parfum artificiel, qui sert à fabriquer l'aniline ;
CH3 — C6H2 (NO2)3, trinitrotoluène ou tolite : T.N.T. (explosif) ;
HO — C6H2(NO2)3, trinitrophénol ou mélinite (explosif).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean ROUXEL : professeur à l'université de Nantes
Classification
Pour citer cet article
Jean ROUXEL. NITRIQUE ACIDE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 033 mots
- 5 médias
En présence d'une toile de platine portée à 700-800 0C l'azote passe au degré + 2 en formant du monoxyde d'azote (oxyde azotique). C'est la réaction de base de la synthèse de l'acide nitrique :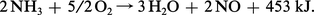
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
La concentration de NO et de NO2 dans la stratosphère résultant d'une production continuelle à partir de N2O (équation 13a) est cependant limitée par d'autres réactions. Nous retiendrons surtout celle qui donne lieu à la formation de l'acide nitrique par le mécanisme :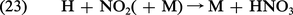
-
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
– L'acide nitrique, HNO3, résulte de l'oxydation naturelle des oxydes d'azote. Il est produit industriellement, car les nitrates servent à fabriquer des engrais et des explosifs. -
EAU RÉGALE
- Écrit par Dina SURDIN
- 223 mots
Mélange de deux ou trois volumes d'acide chlorhydrique concentré et d'un volume d'acide nitrique concentré. Les alchimistes ont appelé ce mélange « eau régale » (c'est-à-dire royale) pour ses propriétés : il dissout en effet l'or et d'autres métaux dits nobles....
- Afficher les 8 références







