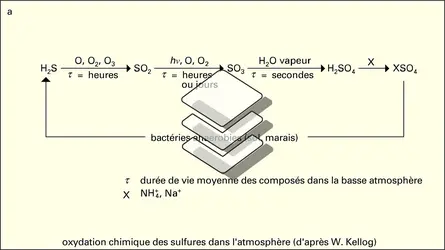
SOUFRE
Composés organiques
Dérivés du soufre bivalent
Thiols, ou mercaptans
Les thiols, ou mercaptans, ont pour formule générale R—SH ; ce sont les analogues sulfurés des alcools (R : aliphatique) et des phénols (R : aromatique) largement utilisés industriellement en agrochimie et en pharmacochimie.
Les termes les plus légers ont une odeur forte, généralement repoussante, mais, quand le nombre d'atomes de carbone de la molécule dépasse 12, l'odeur s'atténue et même disparaît pour les termes les plus lourds.
Les thiols se rencontrent dans de nombreux milieux organiques. On en trouve notamment dans les essences d'ail (prop-2-ènethiol, ou allyl mercaptan), de pamplemousse (p-menthènethiol) et dans l'arôme de viande grillée (furanethiols). Les produits pétroliers contiennent de nombreux mercaptans.
Les thiols peuvent être obtenus par addition d'hydrogène sulfuré à un alcène, vers 160 0C :



Le groupe —SH, caractéristique des thiols, est parfois associé à d'autres fonctions chimiques et est souvent désigné par le préfixe « mercapto ». Il existe dans des aminoacides importants, constituants de protéines ou d'antibiotiques.
La cystéine, dont la formule est HS— CH2—CH(NH2)—CO2H, et le disulfure correspondant, [HCO2—CH(NH2)—CH2—S]2, sont des constituants des protéines.
Sulfures
Les sulfures R—S—R′ correspondent aux oxydes (éthers-oxydes) R—O—R′, mais le soufre est un meilleur nucléophile que l'oxygène, c'est-à-dire qu'il est plus efficace pour se substituer à des groupes ou des atomes électronégatifs comme le brome et l'iode fixés sur une molécule organique. Il en résulte que les ions sulfonium R3S+ sont d'un accès plus aisé que les ions oxonium R3O+.
Les sulfures se rencontrent dans beaucoup de composés naturels. Le sulfure de méthyle a été détecté dans diverses essences végétales et constitue un sous-produit de la fabrication des pâtes à papier par la « méthode au sulfate » ou le procédé Kraft. De nombreux sulfures se trouvent dans les produits pétroliers distillés mais peuvent souvent, comme dans la préparation de la pâte à papier, provenir des réactions chimiques en cours de traitement et ne pas exister dans la matière première.
Un sulfure cyclique C4H8S (tétrahydrothiophène) est un produit industriel important servant à « odoriser » les combustibles pétroliers gazeux pour permettre une détection rapide des fuites éventuelles.
Les sulfures (RSR′) sont généralement obtenus par alkylation d'un thiolate alcalin, ou du sulfure de sodium pour les composés symétriques (R=R′) :


Disulfures[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Fernande CHATAGNER : maître de recherche au C.N.R.S.
- René LECLERCQ : vice-président de l'Institut International du soufre
- Noël LOZAC'H : doyen honoraire de la faculté des sciences de Caen, professeur émérite de l'université de Caen
- Serge MASSON : directeur de recherche au C.N.R.S., Caen
Classification
Pour citer cet article
Fernande CHATAGNER, René LECLERCQ, Noël LOZAC'H et Serge MASSON. SOUFRE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
CARBURANTS
- Écrit par Daniel BALLERINI, Jean-Claude GUIBET, Xavier MONTAGNE
- 10 527 mots
- 9 médias
De façon générale, la fabrication du gazole fait intervenir deux grands types de réactions chimiques : la désulfuration et l'hydrogénation. La première permet d'atteindre de très bas niveaux de teneur en soufre maintenant spécifiés par les réglementations antipollution (10 ppm maximum... -
COLORANTS
- Écrit par Daniel FUES
- 6 772 mots
- 4 médias
Les colorants au soufre sont insolubles dans l'eau. Ainsi, leur application en teinture passe par une réduction alcaline pour aboutir à un composé soluble, appelé leucodérivé, qui de surcroît présente de l'affinité pour les fibres. Le colorant est ensuite réoxydé en sa forme insoluble, qui reste emprisonnée... -
CUIR
- Écrit par Laurent VILLA
- 11 144 mots
- 4 médias
Il en est de même des composés soufrés. La peau prétannée au soufre peut ensuite être tannée aux tanins végétaux. Elle se tanne plus rapidement et, tout en absorbant moins de tanin, fournit un cuir plus souple. Enfin, le cuir prétanné au soufre est susceptible d'absorber des quantités plus importantes... -
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
À l'état réduit, le soufre (S) est un élément indispensable à la vie. À l'état oxydé de sulfate, il constitue le deuxième anion par ordre d'abondance dans les rivières et l'océan (après l'ion chlorure). Son cycle naturel est profondément perturbé, parce que les combustions de charbons et de certains... - Afficher les 24 références
Voir aussi
- VULCANISATION
- SULFURE DE CARBONE
- ANHYDRIDE SULFUREUX ou DIOXYDE DE SOUFRE
- SULFURES
- RÉGULATION MÉTABOLIQUE
- CONDUCTEURS ÉLECTRIQUES
- DISULFURES
- SULFOBACTÉRIES
- CHIMIQUES INDUSTRIES
- FLOTTATION
- CÉTONES
- ALDÉHYDES
- FRIEDEL & CRAFTS RÉACTIONS DE
- OXYDATION
- SULFONIQUES ACIDES
- SULFONATION
- SULFATES
- CYSTÉINE
- PHÉNOTHIAZINES
- MÉTHIONINE
- POLYSULFURES
- DÉSULFURATION
- CYSTATHIONURIE
- THIOFÈNE ou THIOPHÈNE
- MERCAPTANS ou THIOLS
- MÉTABOLIQUES MALADIES
- CYSTATHIONINE
- FRASCH PROCÉDÉ
- SULFOXYDES
- XANTHATES
- ORKLA PROCÉDÉ
- OUTOKUMPU PROCÉDÉ
- SULFONES
- THIAZOLE
- GRILLAGE DES MINERAIS
- HOMOCYSTÉINE
- HOMOCYSTINURIE
- TRANSMÉTHYLATION
- TRANSSULFURATION
- SULFHYDRIQUE ACIDE
- SOUFRE CYCLE DU
- RÉDUCTION, chimie
- ALLOTROPIE
- BIOSYNTHÈSES
- BIOÉNERGÉTIQUE
- ATMOSPHÈRE, chimie
- STÉRÉO-ISOMÉRIE
- CAOUTCHOUC NATUREL
- RÉGULATIONS BIOCHIMIQUES
- SÉRINE
- DÉFICITS ENZYMATIQUE & MÉTABOLIQUE
- ÉNERGIE FOSSILE ou COMBUSTIBLES FOSSILES