MERCURE, élément chimique
Composés mercuriques
Le mercure à l'état mercurique forme des composés stables avec l'azote, le chlore, le brome, l'iode et le soufre ; il forme également des composés avec l'oxygène et le fluor, mais les liaisons dans ces composés sont facilement rompues. Les sels mercuriques qui devraient contenir l'ion mercurique Hg2+ ressemblent aux sels de l'ion hydroxonium H3O+ dans lequel le degré d'ionisation varie avec la nature de l'anion.
Halogénures mercuriques
Le fluorure est essentiellement ionique, il possède la structure de la fluorine CaF2. La distance Hg—F de 0,240 nm est pratiquement égale à la somme des rayons ioniques (rHg2+ = 0,110 nm et rF— = 0,133 nm). C'est un électrolyte fort, mais il est hydrolysé en solution aqueuse en raison de la faiblesse de l'hydroxyde Hg(OH)2.
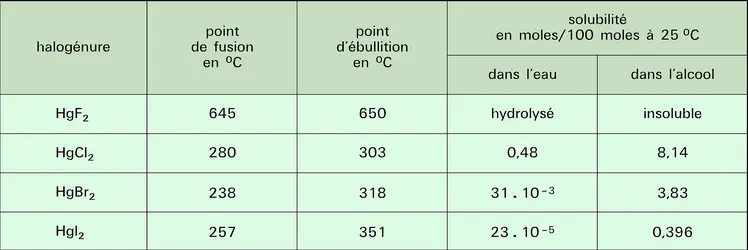
Contrairement au fluorure, les autres halogénures montrent un caractère covalent très marqué, surtout le chlorure mercurique HgCl2 (sublimé corrosif). Ce dernier cristallise, en effet, dans un réseau où les molécules HgCl2 sont très individualisées. Le bromure et l'iodure cristallisent dans un réseau à couches. La solubilité dans l'eau des chlorures, bromures et iodures est très faible ; elle est, par contre, relativement importante dans de nombreux solvants organiques. Le tableau résume les propriétés des halogénures mercuriques.
Oxyde, hydroxyde et sulfure
L'oxyde mercurique existe sous deux formes allotropiques : une variété rouge de symétrie orthorhombique et une variété jaune de symétrie rhomboédrique. L'oxyde mercurique s'obtient par action de l'air ou de l'oxygène sur le mercure au-dessous de 300 0C. C'est un oxyde basique soluble dans les acides dilués, mais peu soluble dans l'eau (10—3 à 10—4 mole/litre).
L'hydroxyde de mercure Hg(OH)2 existe en solution aqueuse, mais n'a jamais pu être isolé ; il est amphotère, mais à caractère très faiblement basique :

Autres sels
Parmi les sels mercuriques présentant un caractère ionique très marqué, on peut citer le nitrate, le sulfate et le perchlorate. Ils sont hydrolysés en solution et ne sont donc stables qu'en milieu acide. Les cyanure, oxalate, phosphate et thiocyanate se rapprochent des halogénures et sont, par conséquent, peu ou pas dissociés en solution.
Complexes mercuriques
L'ion mercurique Hg2+ a une forte tendance à former principalement des complexes à coordinence 2 et 4 (hybridation sp et sp3). Les coordinences 5 et 8 sont plus rares. Les complexes les plus stables sont ceux formés avec les halogénures, le carbone, l'azote, le phosphore et le soufre. Avec les halogènes, on peut citer (HgX)+, HgX2, (HgX3)—, et (HgX4)2—. Avec le cyanure et le thiocyanate, on obtient [Hg(CN)4]2— et [Hg(SCN)4]2—.
Composés organo-mercuriques
La liaison covalente entre le mercure et le carbone est particulièrement forte et remarquable par son inertie chimique. Un nombre important de composés organo-mercuriques qui possèdent des propriétés chimiques et physiologiques intéressantes sont connus. Ils sont de type RHgX et R2Hg (R = radical alkyl ou aryl). Les composés RHgX sont des solides cristallisés dont les propriétés dépendent de la nature de X. Les composés R2Hg sont en général des liquides volatils et toxiques ou des solides à bas point de fusion.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Guy PÉREZ : professeur à la faculté des sciences de Rouen (chimie des solides)
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Pour citer cet article
Guy PÉREZ et Jean-Louis VIGNES. MERCURE, élément chimique [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
MERCURE, toxicologie
- Écrit par Universalis
- 578 mots
Certaines industries modernes mais aussi des processus biologiques aboutissent à une concentration dangereuse des composés mercuriels dans l'organisme humain. Le mercure est largement utilisé dans l'industrie, les produits chimiques, les peintures, divers objets, des pesticides et des...
-
ALCHIMIE
- Écrit par René ALLEAU, Universalis
- 13 642 mots
- 2 médias
...effet, compliquées et dispendieuses, en dépit de leur simplicité apparente : la préparation et l'absorption du cinabre (dan), un sulfure naturel rouge de mercure. À vrai dire, l'expression même de cinabre mâle (yangdan) qui désignait le procédé alchimique par différence avec le nom de cinabre... -
AMÉRIQUE (Histoire) - Amérique espagnole
- Écrit par Jean-Pierre BERTHE
- 21 855 mots
- 13 médias
... siècle, à San Luis Potosí, sur le plateau central mexicain. Mais l'extraction de l' argent est relancée par le procédé de l'amalgame au mercure, mis au point en Nouvelle-Espagne en 1555-1556, au moment même où tarissent un peu partout les premiers filons à grand rendement. Dès 1562-1563,... -
CHLORE
- Écrit par Henri GUÉRIN
- 5 625 mots
- 5 médias
On utilise une cathode circulante en mercure au contact de laquelle le sodium formé s'amalgame tandis que le chlore se dégage ; le mercure contenant environ 0,2 p. 100 de sodium s'écoule de la cellule et passe dans un décomposeur dans lequel il fournit, en présence d'eau, de l'hydrogène et de la soude.... -
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
Le cycle naturel du mercure (Hg) est dominé par le transport atmosphérique et les échanges entre l'atmosphère et la surface des continents ou des océans. Ce métal est relâché par les volcans et par volatilisation depuis les terres et les mers. Ses temps de résidence dans l'atmosphère, les sols et l'océan... - Afficher les 18 références
Voir aussi