HALOGÈNES
Éléments chimiques constituant le sous-groupe VII b de la classification périodique, les halogènes sont au nombre de cinq : le fluor (F), le chlore (Cl), le brome (Br), l' iode (I) et l' astate (At) ; précédant immédiatement chacun des gaz inertes – sauf l'hélium –, ils possèdent 7 électrons de valence et présentent un caractère électronégatif et oxydant très accusé lié à leur tendance à capter un électron pour saturer leurs orbitales de valence à 8 électrons, soit en formant des ions halogénures comme Cl–, soit en établissant des liens de covalence.
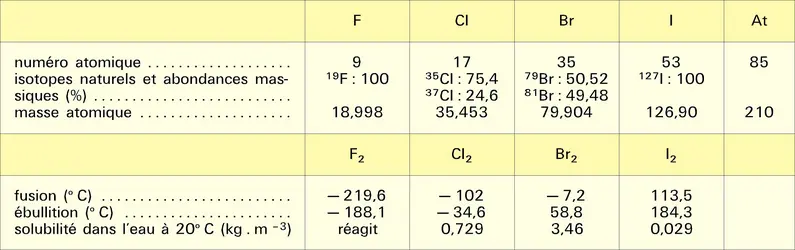
L'identité des structures électroniques (ns2, np5, avec n = 2, 3, 4, 5 et 6 respectivement pour F, Cl, Br, I et At) et la forte électronégativité confèrent à cette famille chimique une grande homogénéité qui ne peut être comparée qu'à celle des gaz inertes et des métaux alcalins. À l'état élémentaire, les atomes sont associés en molécules diatomiques, fait qui explique la grande volatilité des halogènes. Corps simples très réactifs, ils sont susceptibles de former des composés avec presque tous les autres éléments.
Si l'on excepte l'astate – dont les isotopes sont tous radioactifs, ceux de plus longues demi-vies étant artificiels (210At, 8,1 h ; 211At, 7,2 h ; 209At, 5,4 h) et les isotopes naturels descendant de 235U ou de 238U, mais très furtivement (219At, 56 s ; 218At, 1,5 s ; 215At, 0,10 ms) –, la multitude de composés organiques ou minéraux auxquels les halogènes prennent part, leur relative diffusion dans l'écorce terrestre, leurs nombreuses applications à l'état simple ou combiné en font des éléments très importants.
On désigne par « pseudohalogènes » des groupements d'atomes de non-métaux, comme le cyanogène (CN)2 et le thiocyanogène (SCN)2, qui ont en commun avec les halogènes un grand nombre de propriétés, en particulier l'aptitude à former des molécules dimères et le caractère oxydant. De plus, les espèces réduites (CN– et SCN–) sont chimiquement très proches des ions halogénures ; l'ion cyanure CN– possède au plus haut degré la propriété de former des complexes très stables avec les ions d'éléments de transition.
État naturel et isolement
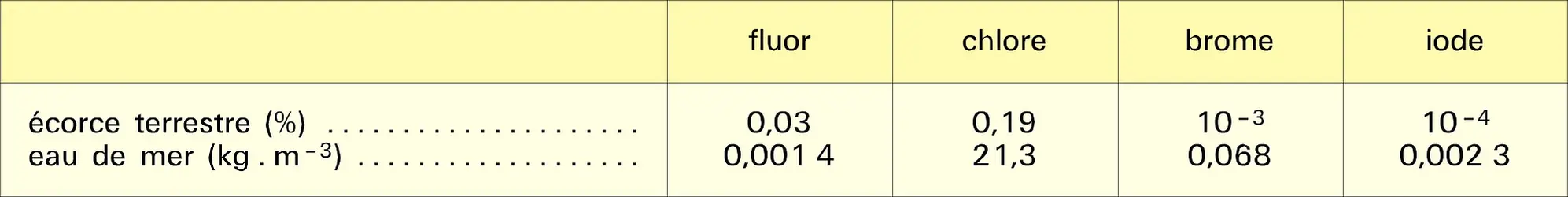
Très réactifs, les halogènes ne sont rencontrés dans la nature qu'à l'état combiné sous forme d'halogénures ou de sels complexes cristallisés ou dissous ; fluor et chlore sont particulièrement abondants dans l'écorce terrestre ; brome et iode sont plus rares (tabl. 1). Chlore, brome et iode, qui forment avec les éléments métalliques abondants des halogénures solubles, se sont concentrés dans les mers actuelles ou fossiles où ils constituent des gisements importants, tels ceux d'Alsace et de Stassfurt (Allemagne). En revanche, le fluor forme avec le calcium des composés peu solubles, ce qui explique sa teneur relativement faible dans l'eau de mer ; ses principaux minerais sont la fluorite (ou fluorine) CaF2, la fluorapatite Ca5(PO4)3F et la cryolite Na3AlF6.
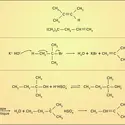
Les corps simples résultent de l'oxydation des ions halogénures suivant la réaction :
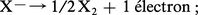
Dans le cas des ions bromure Br–, on utilise une oxydation chimique par le dichlore gazeux :

Les besoins mondiaux en iode – plusieurs milliers de tonnes par an – sont[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
- Robert de PAPE : maître de conférences à la faculté des sciences du Mans
Classification
Pour citer cet article
Jacques METZGER et Robert de PAPE. HALOGÈNES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 640 mots
- 4 médias
-
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
-
ASTATE
- Écrit par Universalis, Bernard PIRE
- 564 mots
Élément chimique de symbole At et de numéro atomique 85, l'astate (du grec astatos, instable) a autrefois été appelé ékaiode (car ses propriétés chimiques se rapprochent de celles de l'iode, l'halogène qui le précède dans le tableau périodique) et alabame. Les Anglo-Saxons le nomment...
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
- Afficher les 14 références
Voir aussi
- CYANOGÈNE
- CHLORURE DE VINYLE
- ÉLECTRONÉGATIVITÉ
- DENSITÉ
- ANHYDRIDES
- HALOGÉNÉS DÉRIVÉS
- HYDRACIDES
- MARKOVNIKOV RÈGLE DE
- ALKYLATION ou ALCOYLATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- DEGRÉ D'OXYDATION
- WURTZ MÉTHODE DE
- OXYDANTS
- DISMUTATION, chimie
- ÉLIMINATION, chimie
- HALOGÉNURES INSATURÉS
- ÉLÉMENTS CHIMIQUES
- CLUSTER
- CYANURES
- CYANATES
- NUCLÉOPHILES SUBSTITUTIONS
- PSEUDO-HALOGÈNES
- TÉFLON ou POLYTÉTRAFLUOROÉTHYLÈNE (PTFE)
- WILLIAMSON RÉACTION DE
- CYANURE DE SODIUM
- CHLOROFORME
- FLUORHYDRIQUE ACIDE
- IODURE D'HYDROGÈNE
- CYANURATION
- CYANHYDRIQUE ACIDE
- FLUIDES FRIGORIGÈNES
- OXYDES
- HALOGÉNURES
- RÉACTIVITÉ CHIMIQUE
- POLYCHLORURE DE VINYLE (PVC) ou CHLORURE DE POLYVINYLE
- TEMPÉRATURE D'ÉBULLITION
- HALOGÉNURES D'ALCÉNYLE
- HALOGÉNURES D'ALKYLE
- HALOGÉNURES D'ARYLE
- CHLOROFLUOROCARBURES (CFC)