MERCURE, élément chimique
Propriétés physiques et chimiques
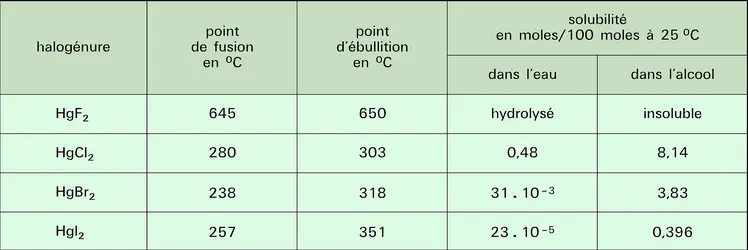
Les principales propriétés physiques sont données au tableau. Le mercure possède huit isotopes naturels : sept stables, de nombres de masse 202 (29,86 p. 100), 200 (23,10 p. 100), 199 (16,87 p. 100), 201 (13,18 p. 100), 198 (9,97 p. 100), 204 (6,87 p. 100), 196 (0,15 p. 100), et un radioactif secondaire, de nombre de masse 206 (traces, demi-vie 8,15 min, descendant de l'uranium 238) ; il existe de nombreux isotopes artificiels. À l'état solide, la structure du mercure est rhomboédrique ; c'est le plus volatil de tous les métaux ; sa vapeur est monoatomique (le mercure étant le seul élément, en dehors des gaz rares, qui donne une vapeur monoatomique à des températures relativement basses).
Le mercure est bon conducteur de l'électricité ; il est, d'autre part, diamagnétique.
La chimie du mercure est unique sous plusieurs aspects. Le mercure forme deux séries de composés : les composés mercuriques dans lesquels l'atome est bicovalent et dont le comportement rappelle les composés analogues du cadmium ; les composés mercureux qui contiennent l'ion (Hg—Hg)2+. Une étude des équilibres entre le mercure et les sels mercureux et mercuriques est indispensable à la compréhension des propriétés chimiques. Les constantes thermodynamiques importantes sont les valeurs des potentiels normaux d'oxydoréduction des équilibres suivants :




Ces valeurs montrent que seuls les agents oxydants possédant un potentiel compris entre 0,79 et 0,85 V peuvent oxyder le mercure en HgI et non en HgII. Aucun agent oxydant usuel ne répondant à cette condition, lorsque le mercure est traité avec un excès d'oxydant, il est entièrement transformé en HgII. Cependant, si le mercure est au moins en excès de 50 p. 100, seul du mercure HgI est obtenu, le mercure réduisant HgII en HgI (4). La constante d'équilibre de la réaction (4) montre néanmoins que Hg22+ n'est stable que dans un domaine de concentration limité ; tous les réactifs susceptibles de déplacer l'équilibre (précipitation ou formation de complexes) produisent la dismutation des sels mercureux en mercure métallique et en sels mercuriques.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Guy PÉREZ : professeur à la faculté des sciences de Rouen (chimie des solides)
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Pour citer cet article
Guy PÉREZ et Jean-Louis VIGNES. MERCURE, élément chimique [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
MERCURE, toxicologie
- Écrit par Universalis
- 578 mots
Certaines industries modernes mais aussi des processus biologiques aboutissent à une concentration dangereuse des composés mercuriels dans l'organisme humain. Le mercure est largement utilisé dans l'industrie, les produits chimiques, les peintures, divers objets, des pesticides et des...
-
ALCHIMIE
- Écrit par René ALLEAU, Universalis
- 13 642 mots
- 2 médias
...effet, compliquées et dispendieuses, en dépit de leur simplicité apparente : la préparation et l'absorption du cinabre (dan), un sulfure naturel rouge de mercure. À vrai dire, l'expression même de cinabre mâle (yangdan) qui désignait le procédé alchimique par différence avec le nom de cinabre... -
AMÉRIQUE (Histoire) - Amérique espagnole
- Écrit par Jean-Pierre BERTHE
- 21 855 mots
- 13 médias
... siècle, à San Luis Potosí, sur le plateau central mexicain. Mais l'extraction de l' argent est relancée par le procédé de l'amalgame au mercure, mis au point en Nouvelle-Espagne en 1555-1556, au moment même où tarissent un peu partout les premiers filons à grand rendement. Dès 1562-1563,... -
CHLORE
- Écrit par Henri GUÉRIN
- 5 625 mots
- 5 médias
On utilise une cathode circulante en mercure au contact de laquelle le sodium formé s'amalgame tandis que le chlore se dégage ; le mercure contenant environ 0,2 p. 100 de sodium s'écoule de la cellule et passe dans un décomposeur dans lequel il fournit, en présence d'eau, de l'hydrogène et de la soude.... -
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
Le cycle naturel du mercure (Hg) est dominé par le transport atmosphérique et les échanges entre l'atmosphère et la surface des continents ou des océans. Ce métal est relâché par les volcans et par volatilisation depuis les terres et les mers. Ses temps de résidence dans l'atmosphère, les sols et l'océan... - Afficher les 18 références
Voir aussi