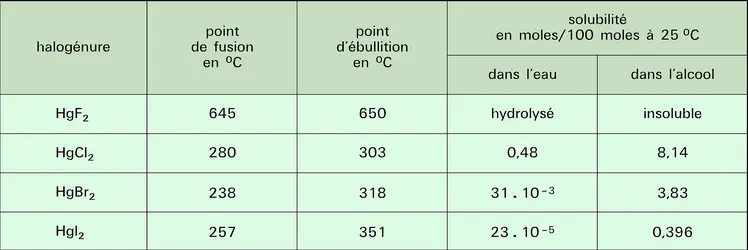
MERCURE, élément chimique
Usages et toxicité
Le mercure, en raison de ses propriétés physiques remarquables (état liquide, conductibilité électrique élevée, masse volumique élevée, tension de vapeur faible, etc.), a été très largement utilisé dans les baromètres, thermomètres, manomètres, pompes à diffusion de vapeur de mercure pour vides très poussés, jauges de McLeod, commutateurs électriques... La surtension importante du dihydrogène sur sa surface ou sur celle d'un amalgame a entraîné son emploi dans des procédés industriels de production de dichlore et d'hydroxyde de sodium par électrolyse de solutions de chlorure de sodium ainsi que dans la fabrication de piles, en polarographie. Il est employé dans les lampes à vapeur de mercure, les lampes à ultraviolet ainsi que dans les lampes fluorescentes, qui en contiennent quelques milligrammes. Les amalgames dentaires sont constitués pour environ la moitié de leur masse par du mercure, l'autre moitié étant de l'argent, de l'étain, du cuivre et du zinc. Il a été pendant longtemps utilisé industriellement dans l'extraction des métaux précieux et son emploi persiste dans des exploitations artisanales, particulièrement en Amazonie. C'est également un catalyseur de nombreuses synthèses organiques.
Plusieurs de ces utilisations sont en voie de disparition en raison de la toxicité du mercure. Le mercure a disparu des piles salines et alcalines, la vente des thermomètres contenant du mercure est interdite en France depuis 1999. En effet, le mercure est toxique quelle que soit sa forme chimique. Les formes les plus toxiques sont les sels minéraux solubles, qui sont des poisons violents, ainsi que les composés organiques tels que le méthyl-mercure, soluble dans les graisses et donc susceptible de franchir les membranes cellulaires, et la vapeur de mercure qui est émise, en quantité non négligeable compte tenu de sa toxicité, à la température ambiante, par le mercure liquide.
Les rejets de mercure dans l'environnement marin forment du méthyl-mercure qui, absorbé par le plancton, se concentre ensuite dans les poissons. La pollution de la baie de Minamata (Japon), de 1956 (année de la découverte des premiers cas d'intoxication humaine) à 1967, par une usine chimique (active depuis 1932) qui utilisait du mercure comme catalyseur pour produire de l'acétaldéhyde a entraîné près d'un millier de morts et de nombreuses personnes sont devenues handicapées pour cette raison.
Actuellement, dans le monde, les émissions naturelles de mercure sont estimées à 3 000 tonnes par an, celles qui résultent d'activités humaines à 4 000 tonnes par an. Ces dernières proviennent pour les deux tiers de la combustion du charbon et pour un quart de l'incinération des déchets. Afin de diminuer ces valeurs, le traitement des fumées de combustion des centrales thermiques au charbon se développe ainsi que le traitement des déchets contenant du mercure et la diminution des quantités de mercure employées ou sa disparition dans de nombreuses applications.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Guy PÉREZ : professeur à la faculté des sciences de Rouen (chimie des solides)
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Pour citer cet article
Guy PÉREZ et Jean-Louis VIGNES. MERCURE, élément chimique [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
MERCURE, toxicologie
- Écrit par Universalis
- 578 mots
Certaines industries modernes mais aussi des processus biologiques aboutissent à une concentration dangereuse des composés mercuriels dans l'organisme humain. Le mercure est largement utilisé dans l'industrie, les produits chimiques, les peintures, divers objets, des pesticides et des...
-
ALCHIMIE
- Écrit par René ALLEAU, Universalis
- 13 642 mots
- 2 médias
...effet, compliquées et dispendieuses, en dépit de leur simplicité apparente : la préparation et l'absorption du cinabre (dan), un sulfure naturel rouge de mercure. À vrai dire, l'expression même de cinabre mâle (yangdan) qui désignait le procédé alchimique par différence avec le nom de cinabre... -
AMÉRIQUE (Histoire) - Amérique espagnole
- Écrit par Jean-Pierre BERTHE
- 21 855 mots
- 13 médias
... siècle, à San Luis Potosí, sur le plateau central mexicain. Mais l'extraction de l' argent est relancée par le procédé de l'amalgame au mercure, mis au point en Nouvelle-Espagne en 1555-1556, au moment même où tarissent un peu partout les premiers filons à grand rendement. Dès 1562-1563,... -
CHLORE
- Écrit par Henri GUÉRIN
- 5 625 mots
- 5 médias
On utilise une cathode circulante en mercure au contact de laquelle le sodium formé s'amalgame tandis que le chlore se dégage ; le mercure contenant environ 0,2 p. 100 de sodium s'écoule de la cellule et passe dans un décomposeur dans lequel il fournit, en présence d'eau, de l'hydrogène et de la soude.... -
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
Le cycle naturel du mercure (Hg) est dominé par le transport atmosphérique et les échanges entre l'atmosphère et la surface des continents ou des océans. Ce métal est relâché par les volcans et par volatilisation depuis les terres et les mers. Ses temps de résidence dans l'atmosphère, les sols et l'océan... - Afficher les 18 références
Voir aussi