OZONE ATMOSPHÉRIQUE
- Article mis en ligne le
- Modifié le
- Écrit par Robert KANDEL
L'ozone de la stratosphère
La formation de l'ozone
Le mécanisme de la production de l'ozone stratosphérique a été élucidé dès 1930 par le géophysicien britannique Sydney Chapman. Pour fabriquer cette molécule constituée de trois atomes d'oxygène, il faut des atomes d'oxygène libres. Aux longueurs d'onde inférieures à 240 nm (énergie E du photon supérieure à 5 électronvolts [eV]), le rayonnement U.V. peut dissocier les molécules d'oxygène O2 de l'atmosphère (fig. 1a) :
(1) O2 + photon (E > 5eV) → O + O.
Peu de photons solaires ont autant d'énergie ; ils disparaissent avec chaque absorption. Au fur et à mesure que l'on s'enfonce dans l'atmosphère, ce flux de photons va donc diminuer, mais, comme le nombre de molécules O2 augmente, le taux de production d'atomes libres d'oxygène atteint son maximum à quelques dizaines de kilomètres d'altitude. À ce niveau peut se former l'ozone par collision entre l'atome libre O et la molécule O2 en présence d'une autre molécule (généralement N2 ou O2) notée M (fig. 1b) :
(2) O2 + O + M → O3 + M.
Trois molécules O2 se convertissent ainsi en deux molécules O3 à l'aide d'un photon U.V. solaire ayant l'énergie nécessaire pour dissocier une molécule O2. Le taux de production d'ozone dans la stratosphère dépend du flux de photons U.V. (qui varie entre zéro la nuit et des valeurs plus ou moins élevées selon la latitude, la saison et l'activité solaire) et de la température.
La destruction naturelle de l'ozone
L'abondance de l'ozone dépend des processus compétitifs de formation et de destruction, ainsi que du transport de l'ozone par la circulation de l'atmosphère. Ce transport joue un rôle important dans la distribution de l'ozone dont la concentration maximale est observée non pas au-dessus de la zone équatoriale (où le flux de photons U.V. est le plus fort), mais à des latitudes relativement élevées, vers la fin du printemps. La quantité totale d'ozone dépasse alors les 400 D.U., et les concentrations les 5 000 ppb.
On a longtemps cru, selon Chapman, que la destruction de l'ozone dépendait essentiellement de l'absorption de photons ayant des énergies supérieures à 1,1 eV :
(3) O3 + photon (E > 1,1 eV) → O2 + O,
cette dissociation étant suivie par la réaction (fig. 1c) :
(4) O3 + O → 2 O2.
Ainsi, avec un des photons abondants du rayonnement visible solaire, on convertit deux molécules d'ozone en trois molécules O2. La réaction (4) n'est cependant pas assez efficace pour expliquer la faible abondance de l'ozone dans la stratosphère. D'autres processus doivent intervenir. Vers 1970, Paul Crutzen et Harold Johnston ont mis en évidence le rôle important des oxydes d'azote (généralement notés NOx), essentiellement le monoxyde d'azote ou oxyde nitrique (NO) et le dioxyde d'azote (NO2). Ces oxydes agissent dans des cycles catalytiques de destruction. Chaque molécule NOx peut servir des milliers de fois dans ces cycles qui transforment deux molécules d'O3 en trois molécules O2 (fig. 1d) :
(5a) O3 + photon (E > 1,1 eV) → O2 + O,
(5b) O + NO2 → O2 + NO,
(5c) O3 + NO → O2 + NO2.
La molécule NO2 est restituée à la fin du cycle.
D'où viennent les oxydes d'azote ? L'atmosphère étant constituée à 99 p. 100 par un mélange de molécules d'azote (N2) et d'oxygène (O2), les oxydes d'azote sont produits chaque fois que la température est suffisamment élevée (combustion dans la troposphère ou dans des réacteurs d'avion, explosions nucléaires dans l'atmosphère). De plus, en fonction de l'activité solaire, les électrons énergétiques des aurores polaires, le rayonnement extrême U.V.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Robert KANDEL : directeur de recherche honoraire du C.N.R.S., laboratoire de météorologie dynamique, École polytechnique, Palaiseau
Classification
Pour citer cet article
Robert KANDEL. OZONE ATMOSPHÉRIQUE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
TROU DANS LA COUCHE D'OZONE
- Écrit par Florence DANIEL
- 315 mots
- 1 média
L'ozone (O3) situé dans la stratosphère joue un rôle protecteur en absorbant les rayons ultraviolets. Une diminution de sa teneur a pour conséquence d'augmenter le bombardement de la surface terrestre par les U.V., ce qui a des effets néfastes sur tous les êtres vivants.
En 1974,...
-
AÉRONOMIE
- Écrit par Gaston KOCKARTS
- 4 157 mots
- 11 médias
...pour assurer la conservation de l'énergie :Dans la stratosphère, il existe une autre réaction très efficace :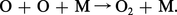 donnant lieu à la formation de l' ozone (O3). Cependant, les molécules d'ozone peuvent être détruites par la réaction :
donnant lieu à la formation de l' ozone (O3). Cependant, les molécules d'ozone peuvent être détruites par la réaction :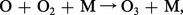 ou peuvent être photodissociées suivant le processus :...
ou peuvent être photodissociées suivant le processus :...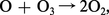
-
AIR
- Écrit par Jean PERROTEY
- 2 154 mots
- 2 médias
...moins en partie, régulée par sa dissolution dans l'eau et par la présence d'énormes masses de calcaires à la surface du globe. Le protoxyde d'azote et l'ozone sont synthétisés dans la haute atmosphère, à une altitude supérieure à 25 kilomètres. L'énergie du rayonnement ultraviolet solaire est en grande... -
ANTARCTIQUE
- Écrit par Pierre CARRIÈRE , Edmond JOUVE , Jean JOUZEL , Gérard JUGIE et Claude LORIUS
- 16 481 mots
- 24 médias
Formé de trois atomes d'oxygène, l'ozone (O3) est un constituant présent dans l'atmosphère en très faible quantité, équivalente à une épaisseur de quelques millimètres dont environ 90 p. 100 entre 20 et 50 kilomètres d'altitude. Son rôle est cependant essentiel, car il absorbe très efficacement... -
ATMOSPHÈRE - La couche atmosphérique terrestre
- Écrit par Jean-Pierre CHALON
- 7 816 mots
- 7 médias
...0,93 p. 100 pour l’argon) conservent une proportion quasiment constante jusqu’à une altitude proche de 80 à 100 kilomètres. Les proportions moyennes en ozone font exception à cette règle : alors qu’elles ne dépassent pas 5 × 10-6 p. 100 (soit 50 molécules d’ozone par milliard de molécules d’air)... - Afficher les 29 références






