IRRÉVERSIBILITÉ
L'irréversibilité est une caractéristique très générale des phénomènes d'évolution observés à notre échelle. Pour des conditions initiales données, un système évolue de manière irréversible lorsqu'il tend vers un état final unique, toujours le même, quel que soit son état initial. Il existe donc, dans ce cas, une direction d'évolution privilégiée qui ne peut être inversée sans l'action d'un agent extérieur au système.
Un exemple caractéristique est fourni par le phénomène de conduction thermique : si l'on met un corps à température élevée en contact avec un corps plus froid, la chaleur passera spontanément du corps chaud vers le corps froid. Ce processus se poursuit jusqu'à l'état final correspondant à l'égalité des températures. Le passage spontané de la chaleur du corps froid vers le corps chaud est impossible.
Le vieillissement biologique nous fournit une autre illustration bien tangible d'irréversibilité, liée ici aux réactions chimiques du métabolisme.
D'une manière générale, c'est l'existence de phénomènes irréversibles qui permet de fixer le sens d'écoulement objectif du temps.
L'irréversibilité en thermodynamique, conséquence du deuxième principe
Le deuxième principe de la thermodynamique codifie l'irréversibilité. Il se formule comme un bilan de la variation d'une fonction d'état du système, appelée l'entropie, communément désignée par la lettre S. La variation dS de l'entropie au cours d'une transformation du système peut toujours se décomposer en deux parties : la variation deS due à l'échange d'énergie et de matière entre le système et le monde extérieur, et la variation diS due à la création ou à la disparition d'entropie au sein du système :
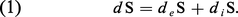
Le deuxième principe de la thermodynamique se formule par l'inégalité :

Le signe d'égalité correspond à des transformations réversibles. Dès lors, dans tous les cas, les transformations irréversibles apportent une contribution positive à l'accroissement d'entropie. Donc l'entropie ne peut que croître dans un système par suite des transformations irréversibles qui s'y produisent. Dans un système isolé (deS = 0), la croissance de l'entropie ne s'arrête que lorsque le système atteint l'équilibre thermique. L'entropie est donc un véritable « indicateur d'irréversibilité ».
Tout en reconnaissant l'importance de l'irréversibilité, les thermodynamiciens classiques étaient plutôt gênés par son universalité. La raison en est la forme particulière du deuxième principe, qui se formule par une inégalité plutôt que par une équation. Les lois qui en résultent fixent des bornes (supérieures ou inférieures), mais ne permettent pas l'évaluation des valeurs exactes des grandeurs liées à l'entropie. Des énoncés thermodynamiques classiques sont du type : « Si la transformation de A à B était réversible, alors... », ou : « Si la transformation était infiniment lente, alors... » Autrement dit, dans l'ignorance de l'augmentation d'entropie, on devait délibérément se placer dans des conditions idéales, mais non réalisées en pratique, où diS = 0.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Radu BALESCU : professeur à l'université de Bruxelles
Classification
Pour citer cet article
Radu BALESCU. IRRÉVERSIBILITÉ [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Autres références
-
AFFINITÉ CHIMIQUE
- Écrit par Paul GLANSDORFF
- 1 166 mots
La notion d'affinité chimique est relativement ancienne. On la rencontre déjà, bien que sous un aspect encore purement qualitatif, dans les spéculations des alchimistes sur la transmutation des métaux au Moyen Âge (Albert le Grand, 1193-1280). Quant au terme lui-même, il semble avoir été...
-
HASARD & NÉCESSITÉ
- Écrit par Universalis, Ilya PRIGOGINE, Isabelle STENGERS
- 9 614 mots
...lutte de Boltzmann, qui tenta en vain de séparer déterminisme dynamique et réversibilité (I. Prigogine et I. Stengers, 1988), c'est-à-dire de montrer que l'évolution irréversible, à entropie croissante, vers l' équilibre thermodynamique si elle n'avait pas de sens en ce qui concerne une particule individuelle,... -
ISOTROPIE & ANISOTROPIE
- Écrit par Viorel SERGIESCO
- 737 mots
Au sens général du terme, une grandeur physique (macroscopique ou microscopique) est anisotrope, ou isotrope, selon qu'elle dépend ou non de la direction suivant laquelle on la mesure. Ainsi, la densité d'un corps homogène ou la fonction de distribution des vitesses à l'équilibre thermodynamique...
-
ONSAGER LARS (1903-1976)
- Écrit par Paul GLANSDORFF
- 588 mots
Chimiste et physicien américain né à Oslo de parents norvégiens. Dès 1925, Lars Onsager obtient dans cette ville son diplôme d'ingénieur chimiste à l'École technique supérieure de Norvège.
Au cours de ses études, Lars Onsager manifeste déjà des dispositions particulières pour...
- Afficher les 17 références
Voir aussi


