AFFINITÉ CHIMIQUE
La notion d'affinité chimique est relativement ancienne. On la rencontre déjà, bien que sous un aspect encore purement qualitatif, dans les spéculations des alchimistes sur la transmutation des métaux au Moyen Âge (Albert le Grand, 1193-1280). Quant au terme lui-même, il semble avoir été introduit en chimie vers 1773 par le Hollandais Boerhaave de Leyde.
Il faut attendre ensuite la seconde moitié du xixe siècle pour assister à un premier essai d'interprétation quantitative, avec l'hypothèse du chimiste français Marcelin Berthelot. En effet, pour ce dernier, la chaleur dégagée par une réaction chimique devait être la mesure de l'affinité de ses divers constituants initiaux.
Toutefois, la contradiction résultant de l'existence de réactions à caractère endothermique fit échouer cette tentative. Elle subsiste néanmoins au titre d'approximation acceptable à basse température.
Une définition correcte et complète a été fournie par le savant belge Théophile De Donder et publiée dans le Bulletin de l'Académie royale de Belgique en mai 1922. Cette fois, le point de vue adopté est essentiellement basé sur le second principe de la thermodynamique. Celui-ci assigne en effet une orientation à tout processus de non-équilibre, par l'intermédiaire du signe positif imposé à la production d'entropie, ou indifféremment, à la chaleur non compensée dQn, fournie par l'inégalité de Carnot-Clausius :

Dans cette relation dS désigne l'accroissement d'entropie consécutif à la quantité élémentaire dQ de chaleur reçue par le milieu envisagé, et T la température absolue de Kelvin.
Ayant pour objet les évolutions chimiques, De Donder introduit d'abord l'intermédiaire de la loi dite des proportions définies de Dalton :

Cette loi exprime que les quantités variables nj, qui désignent le nombre de moles des c constituants du système, dépendent de la seule variable chimique ξ. Les coefficients stoechiométriques μγj sont positifs ou négatifs selon qu'ils concernent un constituant formé ou consommé au cours de la réaction considérée. L'étude du comportement d'un processus chimique constitue donc, en général, un problème à trois variables, dont deux physiques, comme la température T et la pression p, et une chimique ξ. De la même façon, un système de r réactions chimiques, linéairement indépendantes, exige r variables chimiques distinctes :
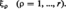
La vitesse de réaction se définit ensuite au moyen de la dérivée par rapport au temps du degré d'avancement, soit v = dξdt. Dès lors, on déduit de l'inégalité (1), la condition :

dans laquelle le signe du premier facteur détermine celui du second et caractérise ainsi le sens adopté par la réaction considérée. Néanmoins, avant de pouvoir attribuer pour cette raison un rôle d'affinité au premier facteur, il importe au préalable d'établir sa signification comme propriété du milieu envisagé. En d'autres termes, il reste à prouver que dQn/dξ caractérise une fonction d'état de ce milieu.
On atteint ce résultat en procédant au développement des expressions différentielles dS et dQ = dH — Vdp, où H désigne l'enthalpie du système conformément au premier principe de conservation de l'énergie, V son volume et p sa pression. Adoptant par exemple les variables indépendantes T, p, ξ, l'inégalité (1) prend la forme :
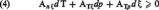
où les coefficients A sont des fonctions de ces variables.
Pour De Donder, la seule cause possible d'irréversibilité au sein d'un système uniforme provient des effets chimiques. Dès lors, on doit avoir les égalités :
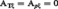
déjà vérifiées pour les systèmes physiques à deux variables. Ensuite, l'intervention de cette propriété dans les divers changements de variables physiques T, p, ξ, → T, V, ξ, ... → x, y, ξ, fait apparaître [...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul GLANSDORFF : professeur émérite de la faculté des sciences à l'université de Bruxelles, président d'honneur de l'Institut international du froid, membre de l'Académie royale
Classification
Pour citer cet article
Paul GLANSDORFF. AFFINITÉ CHIMIQUE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Autres références
-
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD et Jérôme RANDON
- 8 885 mots
- 4 médias
La chromatographie est une méthode de séparation des constituants d'un échantillon basée sur les différences d'affinités de ceux-ci pour chaque phase d'un système biphasique. La séparation s'effectue dans une colonne chromatographique à l'intérieur de laquelle est fixée une phase dite stationnaire.... -
ANTIGÈNES
- Écrit par Joseph ALOUF
- 7 382 mots
- 5 médias
...type IgG constituent l'essentiel de la réponse secondaire, liée à une maturation des lymphocytes qui reflètent le phénomène de la mémoire immunologique. Cette maturation se traduit par une affinité plus élevée des IgG pour l'antigène que ceux qui sont induits au cours de la réponse primaire et constitués... -
CHROMATOGRAPHIE
- Écrit par Robert ROSSET , Louis SAVIDAN et Alain TCHAPLA
- 17 040 mots
- 8 médias
...chromatographie d'adsorption a présidé à l'élaboration de la chromatographie d'affinité qui permet l'isolement de substances biologiques très spécifiques. Le support solide, par exemple un polysaccharide analogue à ceux qu'on emploie en chromatographie sur gel, est chimiquement lié à un ligand biologique... -
ENZYMES - Site actif
- Écrit par Gabriel GACHELIN
- 3 957 mots
- 4 médias
...autres constantes de la réaction,dont on ignore en général les contributions respectives. On admet, et l'approximation est en général bonne, que KM indique un ordre de grandeur de l'affinité de l'enzyme pour son substrat tandis que la constante cinétique Vmaxdonne accès au nombre de... - Afficher les 14 références




