IRRÉVERSIBILITÉ
L'irréversibilité en mécanique statistique
La thermodynamique fournit des relations précieuses reliant entre eux des coefficients différents ; elle ne permet pas de calculer la valeur de ceux-ci. Pour résoudre ce dernier problème, on fait appel à la mécanique statistique, dont le but est l'interprétation des phénomènes macroscopiques au moyen des propriétés et des mouvements des molécules. Mais, alors que le principe de l'étude des états d'équilibre était bien compris depuis longtemps, la théorie de non-équilibre s'est heurtée à des difficultés majeures, qui sont progressivement élucidées avec les découvertes de I. Prigogine.
Équation de Liouville
Considérons par exemple un gaz composé de N particules ponctuelles, qui sont enfermées dans un volume V, et qui interagissent. Si l'on admet que les lois de la mécanique classique sont une approximation suffisante (ce qui est souvent le cas dans ce type de problèmes), l'évolution du système est décrite par les 6N équations de Hamilton, qui donnent la variation temporelle des 3N coordonnées qi et des 3N moments conjugués pi. À partir de ces équations, on déduit une équation unique qui gouverne la fonction de distribution F(q1,..., qN, p1, ..., pN ; t ). Celle-ci représente la densité de probabilité de trouver, à l'instant t, la particule 1 au point de coordonnées q1 avec l'impulsion p1, etc. L'équation d'évolution, appelée équation de Liouville, s'écrit :
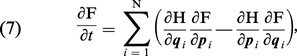
Théorie cinétique de Boltzmann
Historiquement, le premier modèle moléculaire d'un phénomène irréversible fut fourni par la théorie cinétique des gaz de L. Boltzmann, développée à la fin du xixe siècle. Cette théorie concerne la fonction de distribution réduite f1 (q, p ; t ) (densité de probabilité de trouver une particule en q avec l'impulsion p, à l'instant t ). Celle-ci s'obtient à partir de F par intégration sur les variables de toutes les particules sauf une. Au moyen d'arguments semi-intuitifs, Boltzmann a établi une équation, qui porte son nom :
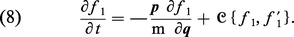
Cette équation exprime le fait que, dans un gaz dilué, la variation temporelle de f1 est due (en l'absence de forces extérieures), d'une part, au mouvement libre des molécules (premier terme du second membre) et, d'autre part, aux collisions entre molécules, dont l'effet s'exprime par le terme non linéaire que l'on a schématisé par le symbole C {f1, f ′1}. L'équation (8) décrit une évolution irréversible. En particulier, Boltzmann a démontré le « théorème H », qui concerne une grandeur S (anciennement désignée par – H) définie comme suit :
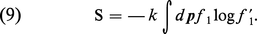
Si l'on calcule la dérivée par rapport au temps de cette grandeur à l'aide de l'équation (8), on trouve une équation qui est exactement de la forme (3), avec σ ≥ 0. L'égalité est réalisée lorsque le gaz atteint l'équilibre thermique, caractérisé par la fonction de distribution de Maxwell. La grandeur S possède donc toutes les propriétés requises de l'entropie thermodynamique. La théorie de Boltzmann fait clairement apparaître les collisions comme la source de l'irréversibilité.
Dès sa publication, la théorie de Boltzmann s'est heurtée à des difficultés sérieuses. Celles-ci ont été cristallisées par les principaux critiques (J. J. Loschmidt, A.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Radu BALESCU : professeur à l'université de Bruxelles
Classification
Pour citer cet article
Radu BALESCU. IRRÉVERSIBILITÉ [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Autres références
-
AFFINITÉ CHIMIQUE
- Écrit par Paul GLANSDORFF
- 1 166 mots
La notion d'affinité chimique est relativement ancienne. On la rencontre déjà, bien que sous un aspect encore purement qualitatif, dans les spéculations des alchimistes sur la transmutation des métaux au Moyen Âge (Albert le Grand, 1193-1280). Quant au terme lui-même, il semble avoir été...
-
HASARD & NÉCESSITÉ
- Écrit par Encyclopædia Universalis , Ilya PRIGOGINE et Isabelle STENGERS
- 9 614 mots
...lutte de Boltzmann, qui tenta en vain de séparer déterminisme dynamique et réversibilité (I. Prigogine et I. Stengers, 1988), c'est-à-dire de montrer que l'évolution irréversible, à entropie croissante, vers l' équilibre thermodynamique si elle n'avait pas de sens en ce qui concerne une particule individuelle,... -
ISOTROPIE & ANISOTROPIE
- Écrit par Viorel SERGIESCO
- 737 mots
Au sens général du terme, une grandeur physique (macroscopique ou microscopique) est anisotrope, ou isotrope, selon qu'elle dépend ou non de la direction suivant laquelle on la mesure. Ainsi, la densité d'un corps homogène ou la fonction de distribution des vitesses à l'équilibre thermodynamique...
-
ONSAGER LARS (1903-1976)
- Écrit par Paul GLANSDORFF
- 588 mots
Chimiste et physicien américain né à Oslo de parents norvégiens. Dès 1925, Lars Onsager obtient dans cette ville son diplôme d'ingénieur chimiste à l'École technique supérieure de Norvège.
Au cours de ses études, Lars Onsager manifeste déjà des dispositions particulières pour...
- Afficher les 17 références

