ÉLECTROCHIMIE
Électrolyse
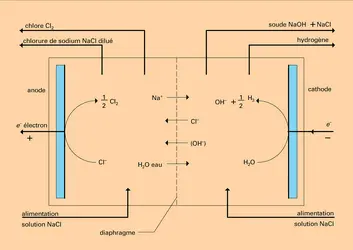
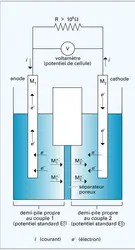
L'électrolyseur type est représenté en figure, où est détaillé le principe du procédé électrolytique chlore-soude. Il est généralement constitué d'une cuve remplie d'un conducteur ionique liquide, soit un solvant polaire additionné d'un électrolyte, soit un sel fondu, dans lequel sont plongées deux pièces métalliques : les électrodes. Lorsque c'est nécessaire, on peut empêcher le mélange par diffusion ou convection des produits formés aux électrodes ou leur réaction à l'autre électrode, au moyen d'une membrane ou d'une paroi de porcelaine perméable aux ions. La cellule est dans ce cas divisée en deux compartiments : l'un contient l'anolyte constituant le conducteur dans lequel baigne l' anode (signe +) et l'autre le catholyte associé à la cathode (signe —).
Les anions migrent vers l'anode où ils se déchargent éventuellement, alors que, inversement, les cations sont attirés par l'électrode de signe —, c'est-à-dire la cathode.
L'électrolyse de l'eau
Ainsi, l'eau additionnée d'un sel dissocié correspondant à un électrolyte fort dont les constituants ioniques sont nettement moins réactifs vis-à-vis des électrodes que l'eau elle-même peut être décomposée électrolytiquement :
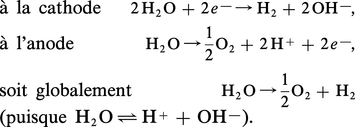
On remarque que, dans une cellule à compartiment séparé, le catholyte devient progressivement basique par l'accumulation des ions hydroxyle au cours de l'électrolyse alors que l'anolyte devient acide par l'augmentation de la concentration des protons. Ce phénomène ne peut se produire avec une cellule à un seul compartiment, puisque ici les effluents anodiques et cathodiques se neutralisent. Dans le cas de solutions non neutres – catholyte et anolyte séparés –, le transfert d'électron intervient en fonction du pH de H3O+ (milieu acide-anode) ou de OH— (milieu basique-cathode). Il y a variation du potentiel d'électrode avec le pH.
La dissociation électrolytique de l'eau réalisée dans des conditions idéales avec un rendement électrique quantitatif pourrait constituer une solution élégante au stockage de l'énergie. La formation d'électricité à partir de H2 et de O2 serait inversement et respectivement l'oxydation et la réduction de ces deux gaz dans des piles (cf. piles et accumulateurs – Les piles à combustibles). Il serait impératif de disposer d'électrodes à faible surtension fonctionnant avec des rendements électriques le plus élevés possible.
Quel potentiel ou quel courant appliquer aux bornes d'un électrolyseur ?
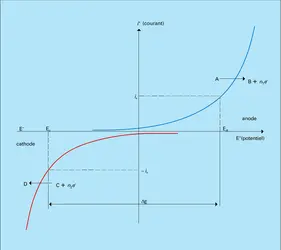
Considérons le cas schématique où l'anolyte conducteur est additionné d'un produit à oxyder A et le catholyte additionné d'un produit à réduire C. Les courbes courant-potentiel telles qu'elles sont représentées sur la figure sont, pour les transformations A → B à l'anode et C → D à la cathode, des fonctions exponentielles. Le transport de matière impliquant A, B, C et D vers et à partir des électrodes où se produisent les conversions n'est pas ici pris en compte pour des courants faibles et des concentrations de A et de C élevées :
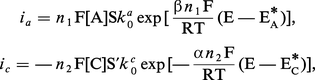
Si un courant d'électrolyse [...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques SIMONET : directeur de recherche au C.N.R.S.
Classification
Pour citer cet article
Jacques SIMONET. ÉLECTROCHIMIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD, Jérôme RANDON
- 8 885 mots
- 4 médias
Les méthodes électrochimiques sont basées sur des réactions d'oxydoréduction. Elles mettent en jeu des échanges d'électrons. Un oxydant est une molécule ou un ion capable de capter un ou plusieurs électrons. En revanche, un réducteur est une molécule ou un ion qui peut donner un... -
AUTOMOBILE - Défis
- Écrit par Daniel BALLERINI, François de CHARENTENAY, André DOUAUD, Francis GODARD, Gérard MAEDER, Jean-Jacques PAYAN
- 11 590 mots
- 8 médias
Qu'est ce qu'une pile à combustible ? C'estun dispositif électrochimique qui utilise directement l'énergie dégagée par une réaction chimique pour la transformer en énergie électrique. Par exemple, la recombinaison de l'hydrogène avec l'oxygène de l'air se fait sur des électrodes en produisant un... -
BECQUEREL ANTOINE CÉSAR (1788-1878)
- Écrit par Georges KAYAS
- 344 mots
Ancien élève de l'École polytechnique (où il entre en 1806), sorti dans le corps des ingénieurs militaires, Becquerel, après la chute de Napoléon, se consacre uniquement à la science et il est le premier à occuper la chaire de physique au Muséum d'histoire naturelle de Paris (1838). Il est le chef...
-
BERZELIUS JÖNS JACOB (1779-1848)
- Écrit par Jacques GUILLERME
- 2 014 mots
- 1 média
Lafascination qu'exerçaient, à la fin du xviiie siècle, les phénomènes électriques est à l'origine de plusieurs tentatives d'interprétation de l'affinité chimique. Ritter avait remarqué que la sériation des métaux par Volta, dans l'ordre des tensions de contact, coïncide avec la série des affinités... - Afficher les 21 références
Voir aussi
- GÉNÉRATEURS D'ÉNERGIE ÉLECTRIQUE
- DISSOCIATION IONIQUE
- OSTWALD LOI DE DILUTION D'
- IONS
- ÉLECTROSTATIQUE
- CONSTANTE DE DISSOCIATION
- COURANT ÉLECTRIQUE
- FARADAY LOIS DE
- HYDROMÉTALLURGIE
- EAU, physico-chimie
- AMPÉROMÉTRIE
- ÉLECTRODES
- NERNST ÉQUATION DE
- IONISÉS MILIEUX
- ANIONS
- CATIONS
- SOLVATATION
- HYDRATATION
- CATHODE
- ANODE
- COULOMÉTRIE
- THERMODYNAMIQUE CHIMIQUE
- OXYDANTS
- RÉDUCTEUR, chimie
- POTENTIEL CHIMIQUE
- CONCENTRATION, chimie
- PILES & ACCUMULATEURS
- FARADAY, unité
- FORCE ÉLECTROMOTRICE
- DENSITÉ DE COURANT
- VOLTAMÉTRIE
- ÉLECTROLYSE
- CHIMIE HISTOIRE DE LA
- COURBE INTENSITÉ-POTENTIEL
- REDOX COUPLE
- DONNEUR, chimie
- ACCEPTEUR, chimie
- TRANSFERT D'ÉLECTRONS
- SCIENCES HISTOIRE DES