COORDINATION (chimie) Composés de coordination
Stabilité et réactivité
La formation d'un complexe en solution correspond au remplacement d'une ou de plusieurs molécules de solvant par un ou plusieurs coordinats A. Dans le cas de la fixation de plusieurs coordinats, la formation du complexe MAr se fait par étapes suivant des équilibres successifs du type MAr-1 + A ⇆ MAr. La stabilité ionique du complexe MAr est alors chiffrée par les valeurs des constantes de stabilité ionique consécutives (ou successives) : Kr = [MAr]/[MAr-1][A] ou celles des constantes de stabilité ionique globales (ou cumulatives) : βr = [MAr]/[M][A]r ; βr = K1 . K2 . K3 ... K r. Il est très important de pouvoir prévoir a priori la stabilité d'un complexe donné. Parmi les différents facteurs influençant cette stabilité, on peut distinguer ceux qui sont liés à la nature de l'ion métallique central et ceux qui sont liés à la nature des coordinats.
Ion métallique central
Si l'on considère qu'un simple modèle électrostatique rend compte des interactions cation-coordinat(s), les constantes de stabilité pour des ions de même charge sont inversement proportionnelles au rayon ionique de l'ion métallique : plus le rayon ionique est petit, plus le complexe est stable.
En outre, les stabilités sont d'autant plus importantes que l'ion métallique central est chargé ; c'est ainsi que l'ion Fe3+, plus petit et plus chargé, exerce une attraction plus forte que l'ion Fe2+, plus gros et de charge plus faible. Ces règles ne sont pas toujours respectées : pour les complexes de l'acide éthylènediamine-tétracétique avec les métaux du groupe IIA de la classification périodique des éléments, la stabilité suit la séquence béryllium < magnésium < calcium > strontium > baryum ; la stabilité des complexes du cuivre (I), argent (I) et or (I) croît fréquemment lorsque le rayon ionique augmente ; des cations de même charge et de rayons ioniques voisins tels calcium Ca2+ (0,099 nm) et cadmium Cd2+ (0,097 nm) conduisent à des complexes de stabilités très différentes avec un coordinat donné. Ces contre-exemples montrent bien que d'autres facteurs doivent être envisagés.
La structure électronique des ions métalliques joue un rôle déterminant. Pour les métaux bivalents, la série d'Irving et Williams est la plus connue : Mn<Fe<Co<Ni<Cu>Zn. Elle s'interprète classiquement à l'aide de la théorie du champ des coordinats et a été vérifiée rigoureusement (Irving, 1959).
Il faut considérer simultanément la relation entre la nature des atomes donneurs et celle de l'ion métallique accepteur. C'est ainsi que les distinctions entre cations ont été discutées par Ahrland et al. (1958) et Schwarzenbach (1961) :
– classe a. Cations à configuration électronique externe de gaz nobles : Li+, Na+, K+, Be2+, Mg2+, Ca2+, Sr2+, Ba2+, Al3+... Ces ions possèdent une faible polarisabilité, une forte électropositivité, un faible rayon ionique, une charge positive élevée et forment des liaisons de type ionique. On aura donc l'ordre d'affinité suivant avec les principaux groupes donneurs :
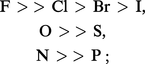
– classe b. Cations à configuration électronique externe à dix-huit électrons : Cu+, Ag+, Au+, Zn2+, Cd2+, Hg2+... Les caractéristiques sont opposées à celles des ions de classe a, conduisant à des liaisons essentiellement covalentes, donc à des ordres d'affinité inversés.
– classe c. De caractère intermédiaire, cette classe comprend notamment les ions des métaux de transition... Fe2+, Co2+, Ni2+, Cu2+.
Ce type de notion a été développé par Pearson (1963) dans la théorie des acides (ions métalliques) durs et mous et des bases (coordinats) dures et molles. C'est la théorie H.S.A.B. (hard and soft acid base theory). La classification correspondante présente[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
- Jean-Pierre SCHARFF : docteur ès sciences physiques, professeur des Universités
Classification
Pour citer cet article
Jean AMIEL et Jean-Pierre SCHARFF. COORDINATION (chimie) - Composés de coordination [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
L'argent se distingue très nettement de ses partenaires du groupe I b.En effet, les coordinations habituelles pour le cuivre et l'or sont 2 et 4, les plus importantes étant 4 pour le cuivre et 2 pour l'or. L'argent adopte indifféremment les coordinations 2, 4 et 6, et la coordination 3 peut aussi... -
CHIMIE - La chimie aujourd'hui
- Écrit par Pierre LASZLO
- 10 856 mots
- 3 médias
Lachimie de coordination étudie les complexes, où un atome de métal s'entoure de molécules neutres ou d'ions, désignés sous le nom de coordinats (ou ligandes ou ligands), qui sont des bases de Lewis, porteuses d'au moins une paire d'électrons. Les ions métalliques ont des orbitales vacantes, ce sont... -
CHIMIE - La nomenclature chimique
- Écrit par Nicole J. MOREAU
- 5 031 mots
- 7 médias
C'est un système additif, développé à l'origine pour lescomposés de coordination, qui sont des composés formés d'un ou plusieurs atomes centraux au(x)quel(s) sont attachés d'autres atomes ou groupes d'atomes, appelés ligands. Ces ligands définissent un polyèdre de coordination... -
COMPLEXES, chimie
- Écrit par René-Antoine PARIS et Jean-Pierre SCHARFF
- 4 304 mots
- 5 médias
...supérieur, résultant de l'association de coordinats en nombre supérieur à celui fixé par la valence normale de l'ion métallique. En effet, la théorie de la coordination fut proposée en 1893 par Alfred Werner (prix Nobel de chimie en 1913) dont les travaux permirent de développer rapidement l'aspect structural... - Afficher les 10 références








