BORE
Dérivés organiques
D'une part, il existe de très nombreux composés de coordination entre un dérivé du bore, le bore servant d'accepteur, et des molécules organiques possédant un atome donneur (O, S, N...). D'autre part, on connaît des dérivés organoboriques dans lesquels le carbone d'un radical organique est lié directement par covalence à un atome de bore, ce qui confère à ces corps des propriétés spécifiques.
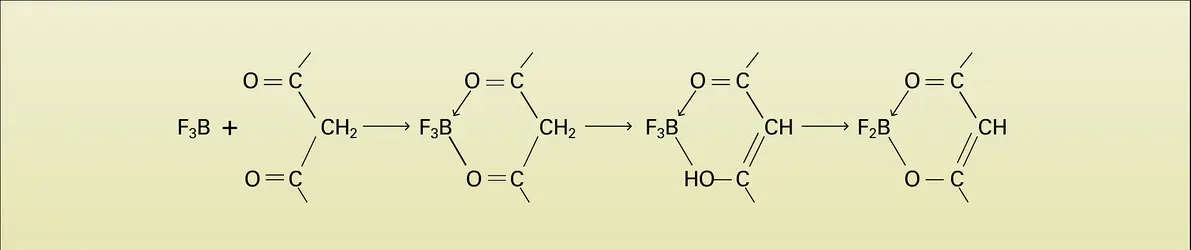
Extrêmement nombreux sont les composés d'addition entre un dérivé de bore et une molécule contenant un atome donneur (alcools, phénols, acides, éthers, aldéhydes, cétones...), ils sont du type R2O → BX3 ou même R2O → (BF3)2 et évoluent souvent avec formation d'ions complexes, où le bore est tétracoordiné :
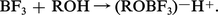
Avec des corps possédant deux fonctions (polyols, diphénols...), on obtient, avec un mécanisme semblable, des dérivés chélatés lorsque la chaîne organique dont fait partie l'atome donneur comporte au moins trois ou quatre atomes le séparant du bore. On obtient ainsi des cycles hexa- ou pentagonaux, dans lesquels le bore est tétracoordiné.
Les composés organoboriques BR3, R étant aliphatique ou aromatique, sont d'étude délicate, car ils sont en général relativement peu stables et parfois auto-inflammables.
On les prépare, en particulier, par action d'un organométallique (Al, Mg, Zn) sur l'anhydride borique, un halogénure de bore ou un borate organique... :

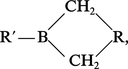
En plus des dérivés simples BR3, on connaît, d'une part, des dérivés mixtes BR2R′ et BRR′R″, assez instables sauf lorsque le bore est lié par deux covalences B−C à un même radical
Par oxydation ménagée de BR3, on obtient des corps instables, souvent auto-inflammables et mal étudiés tels que BR2OH ou BR(OH)2, éthers de l'acide boronique.
Avec des métaux très électropositifs, des composés de type salin ou des anions, les organoboriques conduisent à des ions complexes :
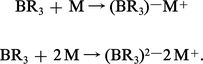
Enfin, pour compléter l'octet du bore, les organoboriques donnent de nombreux composés d'addition avec des molécules contenant un atome donneur, par exemple R3N → BR3.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean CUEILLERON : professeur à la faculté des sciences de Lyon
Classification
Pour citer cet article
Jean CUEILLERON. BORE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER, Gérard FESSIER, Guy HENRY, Joëlle PONTET
- 14 176 mots
- 10 médias
Le bore, ajouté à l'acier en quantité extrêmement faible, accroît la trempabilité et, dans des aciers très spéciaux, améliore la résistance mécanique et la ductilité aux températures élevées. -
BOROPHÈNE
- Écrit par Bernard PIRE
- 990 mots
- 1 média
-
HYDROGÈNE
- Écrit par Paul HAGENMULLER
- 3 539 mots
- 6 médias
-
IONS ÉCHANGEURS D'
- Écrit par Robert ROSSET
- 6 108 mots
- 13 médias
Avec une résine telle que le N-méthyl-glucaminium, la fixation du bore est une réaction pratiquement spécifique mettant en jeu deux chaînes glucidiques pour un ion borate B(OH)-4 avec formation du complexe représenté par la formule de la figure. On peut ainsi récupérer le bore dans des milieux très... - Afficher les 12 références
Voir aussi