SULFURIQUE ACIDE
Fabrication industrielle
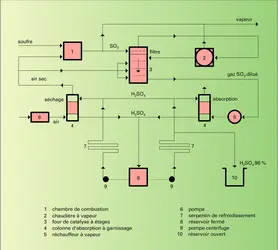
La fabrication de l'acide sulfurique utilise le procédé aux oxydes d'azote (procédé par chambres et par tours) ou le procédé de contact. Elle comprend deux phases successives :
– la préparation et l'épuration d'un mélange d'air et d' anhydride sulfureux SO2 ;
– l'oxydation de SO2 en SO3 à l'aide de vapeurs nitreuses ou de catalyseurs solides.
Préparation de l'anhydride sulfureux
Les matières premières principales sont aujourd'hui le soufre et les minerais sulfurés.
Souvent très pur et facilement purifiable, le soufre élémentaire est la matière de départ la plus simple. Il est extrait pour l'essentiel du golfe du Mexique par le procédé Frasch. De ce fait, l'industrie américaine de l'acide sulfurique repose sur le soufre. On le récupère aussi de certains gaz naturels qui contiennent de l'hydrogène sulfuré H2S. En France, le gisement de Lacq produit environ 1,5 Mt de soufre par an, mais ne sera plus exploité à partir de 2010. La qualité du soufre et le mode de transformation ultérieure du gaz sulfureux décident du choix entre les différentes formes de fours. L'oxydation du soufre brut solide par l'air est réalisée dans des fours rotatifs qui permettent l'évacuation des résidus non volatils. Le soufre liquide, purifié par sédimentation et filtration, est pulvérisé et brûlé à l'état de fine dispersion. La combustion à 1 100 0C dégage une chaleur élevée utilisable pour la production de vapeur :
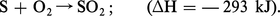
On se contente de gaz à 10 p. 100 de SO2, la seconde phase de la fabrication nécessitant un nouvel apport d'oxygène. La formation de bioxyde d'azote néfaste pour certaines applications de l'acide sulfurique est évitée en ramenant la température de combustion à 800 0C.
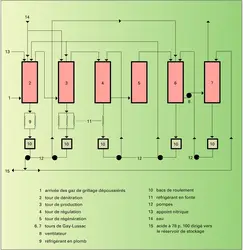
L'industrie de l'acide sulfurique était fondée en grande partie sur la pyrite (FeS2) dont la valeur économique varie suivant le lieu d'origine. La teneur en soufre des pyrites naturelles se situe entre 40 et 50 p. 100 (en théorie : 53,4 p. 100) en raison de la présence de cuivre, de plomb, de zinc, d'arsenic, de cobalt, etc. Certaines de ces impuretés sont valorisables (récupération des métaux nobles), d'autres gênantes (l'arsenic en particulier). Le grillage des pyrites peut se faire dans des fours rotatifs ou à soles étagées, mais leur emploi diminue constamment et ne présente plus qu'un intérêt historique. L'utilisation des pyrites reste importante en ex-U.R.S.S. et en Chine, mais décroît dans de nombreux pays pour des raisons de pollution. Certaines techniques effectuent le grillage éclair (flash roasting) : les poussières de pyrites sont injectées par le haut d'un réacteur chauffé à 1 000 0C et grillées en suspension à l'aide d'un courant d'air secondaire entrant par le bas. Les capacités unitaires de ces fours sont très élevées : 200 tonnes de pyrites par jour ; la récupération de chaleur est bonne. À la différence de tous les autres fours de grillage, les résidus se composent non pas de Fe2O3, mais surtout de Fe3O4, conformément aux équations :
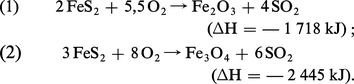
La présence de Fe3O4 est un avantage pour le traitement métallurgique des cendres, car celui-ci demande moins de charbon de réduction. Le procédé flash roasting fut mis au point pour l'utilisation des pyrites de flottation. Lorsque les pyrites ont une granulométrie supérieure à 0,1 mm, un broyage très coûteux s'avère nécessaire. C'est pourquoi le grillage dans des fours à lit fluidisé, selon la réaction (1), apparaît en définitive la solution la plus économique de grillage des minerais sulfurés. La dimension des grains peut alors atteindre 6 mm. L'air de combustion est soufflé de bas en haut à travers un lit de minerai à un débit tel qu'il se forme une suspension dense. À la sortie des fours, les gaz atteignent une concentration[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Gabriel TRIDOT : professeur à l'université des sciences et techniques de Lille-I
Classification
Pour citer cet article
Gabriel TRIDOT. SULFURIQUE ACIDE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les associations entre molécules de solvant sont ici très fortes, comme en témoignent les viscosité et température d'ébullition élevées. -
BÉRYLLIUM
- Écrit par Jean-Paul CARRON, Robert GADEAU, Jean PERROTEY
- 5 410 mots
- 5 médias
L'attaqueau moyen de l'acide sulfuriquecomprend plusieurs étapes : le béryl n'étant pas directement soluble, on peut le rendre réactif par fusion, vers 1 650 0C, au four électrique ; le minerai fondu est grenaillé dans l'eau, puis on le cuit à 900 0C pour précipiter la... -
CADMIUM
- Écrit par Alexandre TRICOT
- 8 050 mots
- 6 médias
L' anhydride sulfureux SO2 produit est consommé en totalité pour la fabrication de l'acide sulfurique H2SO4. -
CATALYSE
- Écrit par Henri Jean-Marie DOU, Jean-Eugène GERMAIN
- 8 394 mots
- 7 médias
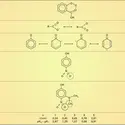
L'une des plus anciennes fabrications de l'industrie chimique, celle de l'acide sulfurique par le procédé des chambres de plomb, illustre la catalyse d'oxydation du gaz sulfureux par l'air en présence d'oxyde azotique (Clément et Desormes, 1806), schématisée de la même façon :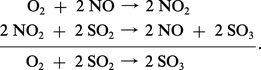
- Afficher les 14 références
Voir aussi