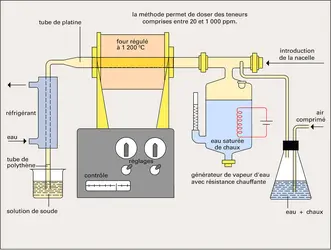
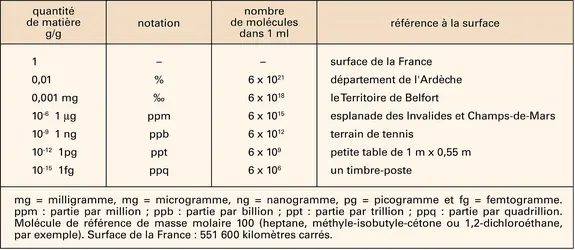
ANALYTIQUE CHIMIE
Traitement de l'échantillon et élimination d'interférences
Méthodes de séparation
On utilise l'une ou l'autre des méthodes de séparation chaque fois qu'il y a interférence sur la détermination directe du produit recherché appelé analyte.
Centrifugation et séparation par membrane
Il est très souvent nécessaire de séparer les particules solides en suspension dans la phase liquide avant de pouvoir analyser celle-ci. La centrifugation et la séparation par membrane permettent d'atteindre cet objectif. Parmi les possibilités de traitement d'échantillon, les techniques à membrane, qui clarifient toujours les solutions, permettent, soit la diminution du taux de sels dans les solutions, soit le retrait des macromolécules, soit la concentration de solutions diluées...
Extraction liquide-liquide
L'extraction liquide-liquide est la plus simple des méthodes de séparation. Elle consiste à faire passer un produit dissous dans une phase liquide, appelé le soluté, dans une seconde phase liquide non miscible avec la première. En pratique, les solutés sont souvent dans une phase aqueuse et on utilise un solvant organique (hexane, éther, acétate d'éthyle, chlorure de méthylène, etc.) pour les extraire. La quantité de soluté A extraite est mesurée par la constante de distribution ou par le coefficient de partage, exprimé par : Korg/aq = [A]org/[A]aq, où [A]org représente la concentration de soluté A dans la phase organique et [A]aq la concentration de A qui reste dans la phase aqueuse à l'équilibre. Plus le coefficient K est grand, plus le volume de solvant organique nécessaire à une bonne extraction peut être réduit. Les coefficients de partage octanol/eau servent d'échelle de référence pour la polarité des composés organiques. Le coefficient Koct/eau de la dieldrine, un insecticide chloré, est de 36 300. Il a été interdit d'utilisation car sa forte affinité pour les milieux organiques (c'est-à-dire sa faible polarité) provoquait son accumulation dans la chaîne alimentaire.
Extraction liquide-solide
Une phase solide peut être utilisée pour séparer un soluté d'une phase liquide. L'extraction liquide-solide utilise la réaction physico-chimique d'adsorption. Le soluté se fixe alors sur la surface solide de l'adsorbant. Le charbon actif, ou noir de carbone, est très utilisé pour extraire les composés organiques peu polaires des phases aqueuses. En revanche, le gel de silice permet d'extraire les composés polaires des phases organiques peu polaires. De petites cartouches prêtes à l'emploi sont commercialisées. Remplies d'un adsorbant purifié, elles permettent d'effectuer rapidement et avec de faibles volumes liquides des extractions liquide-solide de composés polaires ou apolaires.
Chromatographie
La chromatographie est une méthode de séparation des constituants d'un échantillon basée sur les différences d'affinités de ceux-ci pour chaque phase d'un système biphasique. La séparation s'effectue dans une colonne chromatographique à l'intérieur de laquelle est fixée une phase dite stationnaire. Pour avancer dans la colonne chromatographique, les molécules sont entraînées par une phase fluide, appelée phase mobile, qui progresse dans la colonne à vitesse constante. Au cours de leur passage dans la colonne, les solutés vont continuellement diffuser dans la phase mobile, passer de la phase mobile vers la phase stationnaire, passer de la phase stationnaire vers la phase mobile et être entraînés par cette dernière. Chaque type de soluté présente une affinité, qui lui est propre, pour chacune des deux phases. Un soluté passe donc plus au moins de temps dans la phase stationnaire au cours de la traversée de la colonne : il avance dans la colonne à une vitesse apparente qui lui est propre. Ainsi, les constituants d'un mélange pénétrant en même temps à une extrémité de la colonne,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Alain BERTHOD : docteur, professeur agrégé de sciences physiques, directeur de recherche au C.N.R.S.
- Jérôme RANDON : docteur, maître de conférences
Classification
Pour citer cet article
Alain BERTHOD et Jérôme RANDON. ANALYTIQUE CHIMIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Universalis, Pierre KAMOUN
- 3 486 mots
- 6 médias
L'analyse des mélanges d'aminoacides fournis par l'hydrolyse des protéines ou peptides est réalisée à l'aide de techniques permettant la séparation et le dosage soit d'un seul acide aminé, soit de tous les aminoacides. -
ANALYSE ET SYNTHÈSE, chimie
- Écrit par Pierre LASZLO
- 1 526 mots
- 1 média
Ces deux notions, en principe complémentaires et réciproques, ne le sont pas en fait. Certes, les deux tendances à l'analyse et à la synthèse s'opposent, la première visant à couper les entités chimiques en petits morceaux et la seconde se donnant pour objectif la reconstruction des ensembles mis à...
-
ANTIMOINE
- Écrit par Universalis, Jean PERROTEY
- 3 875 mots
- 3 médias
La recherche analytique qualitative se fait par isolement du sulfure, dont la couleur orangée est très remarquable. Le dosage volumétrique est possible avec une solution d'iode, en présence d'acide tartrique et de carbonate de sodium pour stabiliser le pH :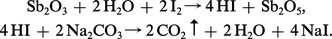
-
ARSENIC
- Écrit par Jean PERROTEY
- 4 498 mots
- 2 médias
Larecherche qualitative de l'arsenic et son dosage revêtent un aspect particulier du fait de leur importance en toxicologie et en pharmacologie, où des résultats fidèles et précis sont exigés. Au laboratoire, l'arsenic peut être isolé à l'état de sulfure arsénieux jaune, précipité en milieu acide par... - Afficher les 35 références
Voir aussi
- SPECTROCHIMIQUE ANALYSE
- ABSORPTION, physique
- QUALITÉ
- COMPLEXOMÉTRIE
- RADIOCHIMIE
- ISOTOPES
- MESURE INSTRUMENTS DE
- RADIOÉLÉMENTS ou RADIONUCLÉIDES ou ISOTOPES RADIOACTIFS
- IONS MÉTALLIQUES
- RÉACTIF, chimie
- SOLUTÉ
- ABSORPTIOMÉTRIE
- ÉCHANTILLON, chimie analytique
- ÉMISSION, physique
- FLUORESCENCE
- CARBONE 14 DATATION PAR LE
- LABELS
- OXYDORÉDUCTION
- RMN (résonance magnétique nucléaire), physico-chimie
- EXCITATION, physique
- TRANSITION, physique
- PARTAGE COEFFICIENT DE
- TRACEURS RADIOACTIFS ou RADIOTRACEURS
- DOSAGE, chimie
- LIGAND ou COORDINAT, chimie
- NÉPHÉLÉMÉTRIE
- CHÉLATES
- EXTRACTION, chimie
- COULOMÉTRIE
- TITRAGE
- SÉPARATION, chimie
- PRÉCIPITATION, chimie
- VOLUMÉTRIE
- TURBIDIMÉTRIE
- CONCENTRATION, chimie
- GRAVIMÉTRIE, chimie analytique
- PRÉCISION
- SENSIBILITÉ, métrologie
- pH
- ÉTALONNAGE
- FORMULE DÉVELOPPÉE PLANE
- LIQUIDE-LIQUIDE SÉPARATION
- NIVEAU, physique atomique
- TEST, statistique
- FLUORESCENCE X
- VOLTAMÉTRIE
- CHIMIE HISTOIRE DE LA
- SOLUTION, chimie
- EDTA (acide éthylène-diamine-tétracétique)
- PHASES, physico-chimie
- CONDUCTIMÉTRIE
- POLARIMÉTRIE
- POTENTIOMÉTRIE
- RAIE SPECTRALE
- SPECTRE D'ABSORPTION
- SPECTRE D'ÉMISSION
- RAMAN SPECTRE
- NORMALISATION
- COORDINATION COMPOSÉS DE
- CHIMIE PHYSIQUE ou PHYSICO-CHIMIE