ANALYTIQUE CHIMIE
Les méthodes de mesure
Une méthode d'analyse repose soit sur la mesure d'une grandeur physico-chimique, soit sur une réaction chimique ou électrochimique.
Mesure de constantes physico-chimiques
Les points d'ébullition, de fusion ou de sublimation, l'indice de réfraction et la densité d'un corps pur permettent de le caractériser. Ces constantes sont listées dans les ouvrages de références de chimie et elles sont couramment mesurées pour contrôler la pureté d'un produit en fin de synthèse.
Les substances faisant tourner le plan de polarisation de la lumière peuvent être caractérisées par leur pouvoir rotatoire. La polarimétrie est ainsi utilisée pour les molécules à structure asymétrique (qui ne possèdent ni plan, ni centre de symétrie). Pour celles-ci, on peut mesurer la différence d'absorbance de la lumière polarisée à droite et à gauche en fonction de la longueur d'onde : on observe alors un dichroïsme circulaire.
L'analyse élémentaire
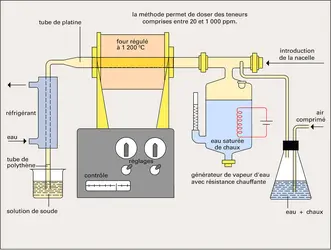
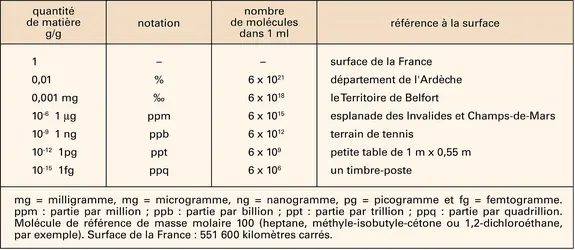
L'analyse élémentaire consiste à établir la formule brute d'un composé chimique. Elle détermine le nombre d'atomes de carbone, d'hydrogène, d'oxygène... contenus dans une molécule du composé. Toutes les déterminations sont fondées sur des réactions chimiques. Le nombre d'atomes de carbone et d'hydrogène contenus dans une molécule organique est déterminé par le dosage du dioxyde de carbone et de la vapeur d'eau formés lors de la combustion de l'échantillon, effectuée dans un bombe à oxygène. La méthode de Kjeldahl donne le nombre d'atomes d'azote dans un composé en le décomposant au moyen d'acide sulfurique concentré et chaud. Les ions ammonium formés sont dosés par une réaction acide-base.
Les méthodes spectroscopiques
Les méthodes spectroscopiques sont des méthodes analytiques fondées sur la mesure d'une radiation électromagnétique et de ses interactions avec l'échantillon.
Une molécule (ou un atome) est caractérisée par son niveau d'énergie fondamental (l'état dans lequel elle se trouve normalement) et par l'ensemble des états excités que cette molécule peut atteindre. Dans un état excité, la molécule possède un niveau d'énergie supérieur à celui de l'état fondamental. Les états excités ayant des niveaux d'énergie bien définis, les passages entre les différents niveaux ne peuvent s'effectuer qu'avec une absorption (passage à un niveau d'énergie supérieur) ou une libération d'énergie (passage à un niveau d'énergie inférieur), correspondant exactement à la différence d'énergie entre ces deux niveaux. Cette énergie peut, dans certains cas, s'exprimer sous la forme d'une radiation électromagnétique de longueur d'onde bien précise. L'ensemble des longueurs d'onde, qui correspondent à des transitions énergétiques dans la molécule, est une caractéristique de la molécule étudiée.
Le domaine d'énergie du spectre électromagnétique étant très large, on peut observer plusieurs types d'interactions entre un échantillon et une radiation électromagnétique. Ainsi les rayons γ (longueur d'onde de l'ordre de 10—14 m) interagissent-ils avec les noyaux des atomes, tandis que les rayons X (de l'ordre de 10—11 m) interagissent avec les électrons des couches internes des atomes. Les ondes situées dans les domaines de l'ultraviolet et du visible (de l'ordre de 10—8 à 10—7 m) provoquent des transitions d'énergie pour les électrons des couches externes des atomes. Les ondes infrarouges (de l'ordre de 10—5m) entraînent des changements de configuration des molécules (élongation et déformation), tandis que les micro-ondes (de l'ordre de 10—4 à 10—3m) provoquent un changement d'orientation de ces molécules. Dans les fours à micro-ondes,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Alain BERTHOD : docteur, professeur agrégé de sciences physiques, directeur de recherche au C.N.R.S.
- Jérôme RANDON : docteur, maître de conférences
Classification
Pour citer cet article
Alain BERTHOD et Jérôme RANDON. ANALYTIQUE CHIMIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Universalis, Pierre KAMOUN
- 3 486 mots
- 6 médias
L'analyse des mélanges d'aminoacides fournis par l'hydrolyse des protéines ou peptides est réalisée à l'aide de techniques permettant la séparation et le dosage soit d'un seul acide aminé, soit de tous les aminoacides. -
ANALYSE ET SYNTHÈSE, chimie
- Écrit par Pierre LASZLO
- 1 526 mots
- 1 média
Ces deux notions, en principe complémentaires et réciproques, ne le sont pas en fait. Certes, les deux tendances à l'analyse et à la synthèse s'opposent, la première visant à couper les entités chimiques en petits morceaux et la seconde se donnant pour objectif la reconstruction des ensembles mis à...
-
ANTIMOINE
- Écrit par Universalis, Jean PERROTEY
- 3 875 mots
- 3 médias
La recherche analytique qualitative se fait par isolement du sulfure, dont la couleur orangée est très remarquable. Le dosage volumétrique est possible avec une solution d'iode, en présence d'acide tartrique et de carbonate de sodium pour stabiliser le pH :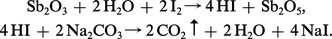
-
ARSENIC
- Écrit par Jean PERROTEY
- 4 498 mots
- 2 médias
Larecherche qualitative de l'arsenic et son dosage revêtent un aspect particulier du fait de leur importance en toxicologie et en pharmacologie, où des résultats fidèles et précis sont exigés. Au laboratoire, l'arsenic peut être isolé à l'état de sulfure arsénieux jaune, précipité en milieu acide par... - Afficher les 35 références
Voir aussi
- SPECTROCHIMIQUE ANALYSE
- ABSORPTION, physique
- QUALITÉ
- COMPLEXOMÉTRIE
- RADIOCHIMIE
- ISOTOPES
- MESURE INSTRUMENTS DE
- RADIOÉLÉMENTS ou RADIONUCLÉIDES ou ISOTOPES RADIOACTIFS
- IONS MÉTALLIQUES
- RÉACTIF, chimie
- SOLUTÉ
- ABSORPTIOMÉTRIE
- ÉCHANTILLON, chimie analytique
- ÉMISSION, physique
- FLUORESCENCE
- CARBONE 14 DATATION PAR LE
- LABELS
- OXYDORÉDUCTION
- RMN (résonance magnétique nucléaire), physico-chimie
- EXCITATION, physique
- TRANSITION, physique
- PARTAGE COEFFICIENT DE
- TRACEURS RADIOACTIFS ou RADIOTRACEURS
- DOSAGE, chimie
- LIGAND ou COORDINAT, chimie
- NÉPHÉLÉMÉTRIE
- CHÉLATES
- EXTRACTION, chimie
- COULOMÉTRIE
- TITRAGE
- SÉPARATION, chimie
- PRÉCIPITATION, chimie
- VOLUMÉTRIE
- TURBIDIMÉTRIE
- CONCENTRATION, chimie
- GRAVIMÉTRIE, chimie analytique
- PRÉCISION
- SENSIBILITÉ, métrologie
- pH
- ÉTALONNAGE
- FORMULE DÉVELOPPÉE PLANE
- LIQUIDE-LIQUIDE SÉPARATION
- NIVEAU, physique atomique
- TEST, statistique
- FLUORESCENCE X
- VOLTAMÉTRIE
- CHIMIE HISTOIRE DE LA
- SOLUTION, chimie
- EDTA (acide éthylène-diamine-tétracétique)
- PHASES, physico-chimie
- CONDUCTIMÉTRIE
- POLARIMÉTRIE
- POTENTIOMÉTRIE
- RAIE SPECTRALE
- SPECTRE D'ABSORPTION
- SPECTRE D'ÉMISSION
- RAMAN SPECTRE
- NORMALISATION
- COORDINATION COMPOSÉS DE
- CHIMIE PHYSIQUE ou PHYSICO-CHIMIE