PHÉNOLS
Propriétés chimiques
Les propriétés chimiques peuvent être classées en cinq groupes : les réactions correspondant à la rupture de la liaison O−H, celles correspondant à la rupture de la liaison C6H5−OH, l'hydrogénation du noyau, les substitutions dans le noyau benzénique et l'oxydation.
Réactions de l'hydrogène mobile
Les phénols sont des acides très faibles, dont le pKA s'échelonne entre 9,5 et 11,5 ; les moins substitués sont les plus acides.
Cette acidité explique une sodation, facile par le métal et totale en présence d'alcoolate ou d'amidure de sodium ; avec les alcalis, la salification est presque totale :

En effet, les phénates ne sont que peu hydrolysés, mais des acides même faibles, en particulier le dioxyde de carbone en présence d'eau, libèrent le phénol de son sel :
Formule v18 ;f0017a02

Les phénols décomposent les organomagnésiens de toute nature :

L'hydrogène hydroxylique est acylé quantitativement par l'action des chlorures ou des anhydrides d'acides :

Par contre, l'action des acides (estérification) est lente et très limitée.
L' alkylation sur l'oxygène se fait facilement en milieu alcalin : l'ion phénate est l'agent de la réaction :
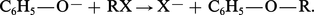
L'hydrogène hydroxylique peut être remplacé par le groupe diazoïque, à condition que le phénol ne porte pas d'hydrogène sur le noyau en position para-, ou, parfois, qu'il n'en porte ni en ortho- ni en para- ; cette condensation (5) se fait en milieu alcalin ; elle conduit au diazophénol et est réversible.
Toutefois, par une transposition semi-dinique, beaucoup de dérivés de substitution à l'oxygène s'isomérisent plus ou moins facilement mais irréversiblement (6).
C'est ainsi qu'il est parfois très difficile de savoir si une substitution se fait directement sur le noyau ou si elle résulte d'une transposition d'un phénol substitué à l'oxygène. Il est cependant des cas où le dérivé de substitution à l'oxygène est parfaitement isolable ; c'est ainsi que le phénol sodé anhydre fixe le dioxyde de carbone en formant le carbonate mixte C6H5−OCOONa qui ne s'isomérise qu'à chaud en salicylate de sodium.
Substitutions de l'hydroxyle
Les acides les plus forts sont incapables, dans le cas des phénols simples, de remplacer l'hydroxyle par un autre anion ; cependant, cette substitution devient facile si le phénol porte en ortho- et en para- des groupes accepteurs forts comme −NO2 (préparation du chlorure de picryle à partir de l'acide picrique). Mais PCl5 transforme les phénols en chlorures d'aryle :

D'ailleurs, OPCl3 réagit sur trois autres molécules du phénol en formant le phosphate de phényle :

À haute température (350 0C), en présence d'alumine, les phénols sont déshydratés en éthers-phényliques :

Enfin, vers 300 0C, l'aniline et le phénol forment la diphénylamine :

Hydrogénations
L 'hydrogénation chimique du noyau est pratiquement impossible ; l'hydrogénation catalytique sur nickel est, par contre, plus facile que celle du benzène ; selon la température, elle conduit au cyclohexanol ou à la cyclohexanone.
On peut, d'ailleurs, supposer que la cyclohexanone résulte de la déshydrogénation du cyclohexanol à température élevée. Cette hydrogénation a une grande importance pratique : en effet, cyclohexanol et cyclohexanone sont oxydés quantitativement, par rupture du cycle, en acide adipique HOC(O)−(CH2)4−COOH, intermédiaire dans la synthèse du nylon 6-6.
En présence de platine à froid, on obtient également le cyclohexanol, mais il a été démontré qu'il se forme entre-temps la cyclohexanone, car on peut la capter, au cours de la réaction, par un réactif approprié.
On explique parfois cet intermédiaire en postulant que[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. PHÉNOLS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ANTISEPSIE ET ASEPSIE
- Écrit par Gabriel GACHELIN
- 587 mots
- 1 média
Classiquement, l’histoire de la chirurgie est scandée par deux dates : l’année 1846, au cours de laquelle l’anesthésie à l’éther est utilisée pour la première fois ; l’année 1867, au cours de laquelle le chirurgien britannique Joseph Lister (1827-1912) décrit le succès d’une...
-
AZOÏQUES
- Écrit par Henri WAHL
- 2 194 mots
- 2 médias
Avec les phénols et les énols, la copulation a lieu en milieu alcalin et le reste diazoïque s'introduit également en para-, à défaut en ortho- du groupe phénolique, jamais en méta-. Dans quelques cas, on peut isoler, intermédiairement, un diazo-éther :
-
COLLAGE, physique
- Écrit par Jacques COGNARD
- 6 455 mots
- 2 médias
...Les colles phénoliques sont les plus anciennes colles de réaction. Leur durcissement résulte d'une polycondensation de la formaldéhyde (CH2O) avec un phénol qui s'accompagne de la formation d'une molécule d'eau. Elles sont essentiellement utilisées pour assembler les substrats poreux comme le ... -
CRÉSOL
- Écrit par Bernard BACH
- 213 mots
Mélange des trois isomères du méthylphénol (CH3—C6H4OH) en position ortho-, méta- et para-, qui sont tous d'odeur désagréable, mais moins toxiques que le phénol ordinaire. Les créosols sont des antiseptiques puissants.
À partir du mélange des trois isomères (acide crésylique), on...





