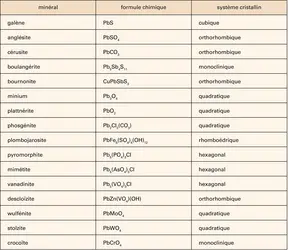
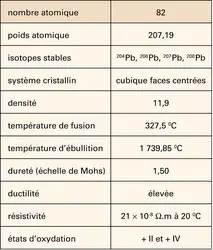
PLOMB
Principaux composés
Le plomb possède à l'état fondamental la structure électronique 6 s2, 6 p2. Comme le germanium et l'étain, il peut donner naissance à des ions divalents par perte des seuls électrons p ou à des ions tétravalents par arrachement de la totalité des électrons périphériques. Le degré d'oxydation + II (à l'inverse de ce qui était observé dans le cas des éléments supérieurs de la colonne IV du tableau périodique) présente une stabilité très supérieure à celle du degré + IV. Pour traduire la résistance que manifestent les électrons 6 s2 à participer à une liaison, on les désigne souvent par l'expression « doublet inerte ».
Les potentiels normaux d'oxydoréduction correspondant aux couples Pb2+/Pb et Pb4+/Pb2+ sont respectivement — 0,13 et 1,8 V à pH = 0.
Degré d'oxydation + IV
Le caractère oxydant de l' oxyde PbO2 est fortement abaissé en milieu basique. Il peut être obtenu par oxydation des ions plombites par le chlore ou les ions hypochlorites :
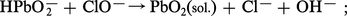
L'oxyde PbO2 présente toujours un déficit en oxygène. Cet écart à la stœchiométrie explique sa coloration brun-noir et sa conductivité électrique (104 Ω—1 ( cm—1). Il possède sous pression normale la structure rutile. Par accroissement de pression, il acquiert successivement la structure de la colombite (FeNb2O6), puis celle de la fluorine (CaF2), la coordinence s'élevant de 6 à 8 au cours de cette seconde transformation. La seconde variété se forme dans les accumulateurs.
L'oxyde PbO2 est utilisé dans les accumulateurs au plomb. Ceux-ci sont constitués d'une anode en plomb et d'une cathode en oxyde PbO2, plongées dans une solution aqueuse d'acide sulfurique. Au cours de la décharge se produisent les réactions suivantes à l'anode :
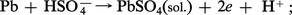

Le sulfate de plomb insoluble PbSO4 qui se forme aux électrodes y adhère. Pendant la charge, les réactions sont inversées.
L'oxyde PbO2 se dissout dans les solutions de soude ou de potasse concentrées avec formation d'ions plombates PbO32— et PbO44—. Par refroidissement, les hydroxoplombates Na2Pb(OH)6 et K2Pb(OH)6 précipitent.
La faible stabilité thermique de PbO2, qui se décompose dès 400 0C sous pression d'oxygène d'une atmosphère en minium Pb3O4, explique le nombre restreint de plombates anhydres isolés. Dans ces conditions, ne sont accessibles que les plombates alcalins et alcalino-terreux. L'utilisation de techniques de haute pression a permis l'obtention de nouvelles familles de plombates (pyrochlores Ln2Pb2O7 par exemple. Ln étant un élément lanthanidique). Les plombates présentent de grandes analogies structurales avec les stannates. Le plomb y possède généralement la coordinence 6 (Na2PbO3, SrPbO3, BaPbO3), parfois la coordinence 5 (K2PbO3).
Si l'on excepte les fluorures (une série de fluorures doubles de plomb et d'un élément divalent de formule MPbF6, M = Zn, Ni, Sr..., a été récemment isolée), les autres composés du plomb tétravalent sont en nombre très limité : citons le chlorure PbCl4 (le bromure et l'iodure n'ont pu en revanche être préparés), le sulfate Pb(SO4)2, l'acétate Pb(CH3COO)4 utilisé comme oxydant en chimie organique. Leur température de décomposition est souvent voisine de la température ambiante.
Degré d'oxydation + II
L'oxyde PbO a été mis en évidence sous deux variétés, l'une rouge (litharge), l'autre jaune (massicot), dont la température de transformation se situe à 486 0C. Ces deux structures sont caractérisées par l'existence de pyramides (PbO4) assemblées en couches dont la cohésion est assurée par des forces de Van der Waals. Cette configuration particulière du plomb s'explique par un mode d'hybridation complexe[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Claude FOUASSIER : ancien élève de l'École normale supérieure, docteur ès sciences, directeur de recherche au C.N.R.S.
- Michel PÉREYRE : professeur à l'université de Bordeaux-I, directeur de recherche au C.N.R.S.
- Michel RABINOVITCH : ingénieur géologue
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Pour citer cet article
Claude FOUASSIER, Michel PÉREYRE, Michel RABINOVITCH et Jean-Louis VIGNES. PLOMB [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
PLOMB, toxicologie
- Écrit par Universalis
- 499 mots
Encore appelée saturnisme, l'intoxication au plomb résulte de l'accumulation de ce dernier dans les tissus humains, à la suite de l'exposition répétée aux objets ou aux aliments contenant ce métal.
À la maison, il s'agit des peintures recelant du plomb et de l'eau de boisson ayant...
-
ÂGE DE LA TERRE
- Écrit par Pascal RICHET
- 5 143 mots
- 5 médias
...Kelvin ! On comprit ensuite que l’uranium et le thorium étaient les points de départ de longues chaînes de désintégration dont le terme commun était le plomb. La teneur en plomb accumulé dans un minéral uranifère constituait donc aussi un chronomètre. À Londres, Arthur Holmes (1890-1965) mit en œuvre... -
ALIMENTATION (Aliments) - Risques alimentaires
- Écrit par Jean-Pierre RUASSE
- 4 757 mots
- 1 média
Un exemple bien connu, toujours actuel bien qu'en régression, de contamination accidentelle est donné par la présence de plomb dans le vin. Provenant du traitement des vignobles par l'arséniate de plomb, de l'apport de plomb sur le raisin par les poussières du sol (principalement le long des routes,... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
-
ANTIMOINE
- Écrit par Universalis, Jean PERROTEY
- 3 875 mots
- 3 médias
...la production mondiale annuelle (qui s'élève à 70 000 t environ) est consommée comme élément durcissant dans les alliages à base d' étain et surtout de plomb. Les plaques des batteries d'accumulateurs, qui doivent présenter une grande résistance, sont constituées de plomb allié à environ 6 p. 100 d'antimoine.... - Afficher les 22 références
Voir aussi
- GALÈNE (sulfure de plomb)
- SULFURES
- MINÉRALE CHIMIE
- CHIMIQUES SUBSTANCES, écotoxicologie
- GISEMENTS MÉTALLIFÈRES
- CÂBLES SOUS-MARINS
- EXTRACTION, métallurgie
- PLOMB ACCUMULATEUR AU
- ANTIFRICTION ALLIAGES
- AFFINAGE, métallurgie
- DEGRÉ D'OXYDATION
- GRABEN ou FOSSÉ D'EFFONDREMENT
- ANTIDÉTONANTS
- CHALCOPYRITE
- DOLOMIES
- PLOMBATES
- ÉLECTRONIQUE STRUCTURE
- DÉTRITIQUES ROCHES
- MÉTAMORPHISME
- CARBONATÉES ROCHES
- ARGILES LITÉES ou SHALES
- PLOMB TÉTRAÉTHYLE
- GRILLAGE DES MINERAIS
- CÂBLES ÉLECTRIQUES
- MÉTALLOGÉNIE
- STRATIFORME GISEMENT
- MINÉRALISATION, métallogénie
- OXYDES
- HALOGÉNURES
- INTRUSION, géologie