BORE
Bore élémentaire
L'obtention de bore de pureté élevée a donné lieu à de nombreux travaux car des traces de corps étrangers agissent considérablement sur son état cristallin et sur ses propriétés physiques et chimiques. Sa préparation est rendue délicate par sa grande réactivité chimique.
Le bore est obtenu par réduction à chaud de l'anhydride borique B2O3 par un métal très réducteur (Mg, Al, Ca, alcalins), ou par électrolyse à 1 100 0C d'anhydride borique ou de borates fondus contenant en dissolution divers sels de magnésium ; il y a alors, en fait, réduction de l'anhydride borique ou des borates par le magnésium libéré lors de l'électrolyse. Le bore ainsi obtenu contient des sels métalliques, des borures qu'on élimine par ébullition avec des acides, puis, éventuellement, par fusion avec B2O3 et par chauffage sous vide. On arrive ainsi à un produit dont le titre ne dépasse pas 90 p. 100.
Les halogénures de bore (surtout le chlorure) peuvent être réduits par l'hydrogène (procédé Van Arkel ou dérivés) ou par divers métaux (Mg, Al, Fe, Ni, alcalins, Zn...). Le bore ainsi obtenu est de pureté élevée, puisque, selon les conditions opératoires, les produits de la réaction sont éliminés.
On fait appel également à la dissociation thermique des halogénures, du sulfure et surtout des hydrures.
Le bore se présente sous forme d'une poudre brun-noir, couleur qu'il garde après avoir été fondu ou dispersé à l'état de suspension colloïdale.
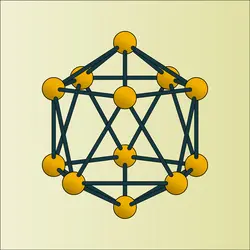
Ses propriétés physiques semblent varier avec son état cristallin. Il existe en effet, au moins sous deux formes : rhomboédrique α stable en dessous de 1 500 0C (douze atomes par maille) et rhomboédrique β stable à haute température (cent huit atomes par maille) ; on admet au moins une forme quadratique (cinquante atomes par maille) obtenue par refroidissement brutal à partir de 1 500 0C.
Comme conséquence de sa structure électronique, la densité du bore est élevée (2,3) ; sa dureté est presque aussi grande que celle du diamant ; ses coefficients de dilatation et de compressibilité sont très faibles ; son point de fusion est élevé (≃ 2 400 0C) et son spectre de flamme est simple (vingt-cinq raies surtout dans le vert et le jaune).
À cause de sa faible masse atomique, le bore ne vérifie la loi de Dulong et Petit qu'à température élevée.
De même que les propriétés physiques, les propriétés chimiques du bore restent à préciser, car elles ont été le plus souvent déterminées sur des échantillons de pureté insuffisante.
Le bore est capable, éventuellement à température élevée, de s'unir à presque tous les autres éléments, ceci le plus souvent de façon très exothermique. Réducteur extrêmement énergique, il peut agir facilement sur l'ensemble des composés oxygénés, sulfurés, halogénés, azotés... des autres éléments. Sa chimie, dont l'étude est, de ce fait, très délicate, est, par divers aspects, à rapprocher de celles du carbone et du silicium.
L'étude est encore compliquée par des difficultés analytiques. La mise en solution du bore et de certains de ses dérivés est très laborieuse, les séparations souvent complexes et il est délicat de différencier dans un mélange le bore libre du bore combiné (oxydation sélective du bore libre par Ce4+ MnO4-...).
Si on décèle facilement sa présence par le fait qu'il colore la flamme en vert (après transformation éventuelle en halogénure ou en ester de l'acide borique), on dose péniblement le bore par gravimétrie (après séparation à l'état de borate de méthyle) ou mieux par acidimétrie (après transformation en acide borique) ; pour les traces, on opère par spectrographie, par colorimétrie, ou en mettant en jeu des réactions colorées (papier au curcuma). La précision des dosages est faible (1 à 2 p. 100).
Il est à noter[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean CUEILLERON : professeur à la faculté des sciences de Lyon
Classification
Pour citer cet article
Jean CUEILLERON. BORE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER, Gérard FESSIER, Guy HENRY, Joëlle PONTET
- 14 176 mots
- 10 médias
Le bore, ajouté à l'acier en quantité extrêmement faible, accroît la trempabilité et, dans des aciers très spéciaux, améliore la résistance mécanique et la ductilité aux températures élevées. -
BOROPHÈNE
- Écrit par Bernard PIRE
- 990 mots
- 1 média
-
HYDROGÈNE
- Écrit par Paul HAGENMULLER
- 3 539 mots
- 6 médias
-
IONS ÉCHANGEURS D'
- Écrit par Robert ROSSET
- 6 108 mots
- 13 médias
Avec une résine telle que le N-méthyl-glucaminium, la fixation du bore est une réaction pratiquement spécifique mettant en jeu deux chaînes glucidiques pour un ion borate B(OH)-4 avec formation du complexe représenté par la formule de la figure. On peut ainsi récupérer le bore dans des milieux très... - Afficher les 12 références
Voir aussi