BORE
Dérivés hydrogénés ou boranes
Le bore et l'hydrogène donnent une série de composés qui sont, suivant le poids moléculaire, gazeux, liquides ou solides.
L'étude de ces produits réducteurs et le plus souvent hydrolysables est particulièrement complexe. Ils sont instables : les hydrures légers se transforment avec perte d'hydrogène en un mélange de termes supérieurs pour aboutir à des solides (BH)n qui n'ont pu être encore étudiés ; ces transformations se font à la suite de mécanismes mal connus au cours desquels on passe par le groupe BH3 non isolé. De plus, ces corps sont hautement toxiques et certains d'entre eux forment avec l'air des mélanges auto-explosifs.
Préparés initialement par pyrolyse de tétraborane B4H10 (obtenu lui-même par hydrolyse du borure de magnésium), les boranes s'obtiennent par décomposition thermique du diborane B2H6. Le diborane peut être obtenu à partir des organoboranes ou par action d'un acide de Lewis sur un borohydrure (ou hydroborure, ou boranate), par exemple :

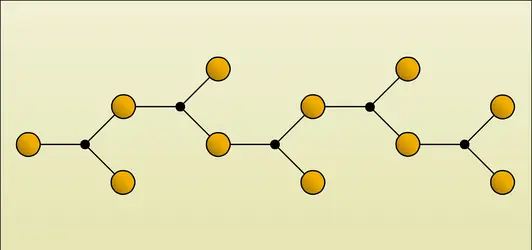
De façon peu satisfaisante, on classe les boranes en deux séries : BnHn+4 (B2H6 ; B5H9 ; B6H10 ; B10H14) et BnHn+6 (B4H10 ; B5H11 ; B7H13 ; B9H17). En effet, d'une part certains hydrures ne font pas partie de ces groupes, d'autre part, au cours des réactions chimiques, B4H10 se coupe en BH3 et B3H7 alors que B9H15 semble correspondre à l'association, avec perte d'hydrogène, de B4H10 et de B5H9. Enfin les ions borohydrures (BH4)- et (B3H8)- dérivent des hydrures BH3 et B3H7, non isolés, mais qu'on sait stabiliser sous forme de dérivés de coordination tels que R2O → B3H7.
La structure des hydrures de bore est très complexe. On admet, par exemple pour B2H6, que deux groupes, BH3 sont liés par « pont hydrogène », c'est-à-dire par une combinaison de l'orbitale de l'hydrogène et des orbitales hybrides du bore ; ce type de liaison se retrouve dans les boranes supérieurs. En effet le diborane B2H6 est très différent de l'éthane C2H6 avec lequel il avait été initialement comparé puisque, le bore étant trivalent, il est impossible d'écrire, par exemple, H3B−BH3. De plus, les déterminations physico-chimiques montrent que la distance des deux atomes de bore dans B2H6 est supérieure à celle qui existe dans une covalence normale B−B. Par ailleurs, bien qu'il existe des dérivés B2H5X, on ne sait obtenir que des corps de formules B2R4H2 ; ceci implique pour deux atomes d'hydrogène des propriétés particulières. On constate encore que, comme pour une liaison éthylénique, la libre rotation autour de l'axe B−B est impossible. Enfin, sous l'action de corps possédant un atome donneur d'électrons (O, N, P...) : alcools, éthers, aldéhydes..., le diborane se coupe en donnant des composés d'addition tels que :

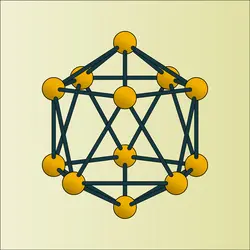
La structure des hydrures supérieurs correspond à l'assemblage triangulaire d'atomes de bore, les triangles se groupant entre eux et tendant à former à la limite un icosaèdre. Toutefois l'hydrure B12H12 est inconnu, car sa formation correspondrait à un déficit électronique. Par contre, on connaît l'ion (B12H12)2-, dernier terme de la série (BnHn)3-, n étant compris entre 3 et 12, et divers dérivés tels que (B12Cl12)2-. Dans ces conditions pour combler le déficit électronique des carbures neutres qui correspondraient aux ions (BnHn)2-, il est possible de remplacer deux atomes de bore par deux atomes de carbone. On passe ainsi à la série des « carboranes » C2BnHn+2, n étant compris entre 2 et 10. Seuls les termes de rang élevé sont relativement bien connus et, fonction des isoméries possibles, la nomenclature reste à établir.
Les borohydrures, eux, sont préparés par action d'un hydrure alcalin (ou du métal en présence d'hydrogène) sur un halogénure de bore :

Ces corps sont des réducteurs[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean CUEILLERON : professeur à la faculté des sciences de Lyon
Classification
Pour citer cet article
Jean CUEILLERON. BORE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER, Gérard FESSIER, Guy HENRY, Joëlle PONTET
- 14 176 mots
- 10 médias
Le bore, ajouté à l'acier en quantité extrêmement faible, accroît la trempabilité et, dans des aciers très spéciaux, améliore la résistance mécanique et la ductilité aux températures élevées. -
BOROPHÈNE
- Écrit par Bernard PIRE
- 990 mots
- 1 média
-
HYDROGÈNE
- Écrit par Paul HAGENMULLER
- 3 539 mots
- 6 médias
-
IONS ÉCHANGEURS D'
- Écrit par Robert ROSSET
- 6 108 mots
- 13 médias
Avec une résine telle que le N-méthyl-glucaminium, la fixation du bore est une réaction pratiquement spécifique mettant en jeu deux chaînes glucidiques pour un ion borate B(OH)-4 avec formation du complexe représenté par la formule de la figure. On peut ainsi récupérer le bore dans des milieux très... - Afficher les 12 références
Voir aussi