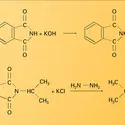
AZOTE
L' azote est un gaz incolore, inodore et sans saveur qui constitue un peu plus des trois quarts du volume de l'atmosphère. Il existe également dans les fumerolles volcaniques.
Certaines météorites en renferment et, par des méthodes spectroscopiques, on a mis sa présence en évidence dans le Soleil et de nombreuses étoiles.
Bien que ses composés soient présents dans un grand nombre de substances naturelles, son importance quantitative dans la lithosphère et l'hydrosphère du globe terrestre est négligeable. C'est pourquoi on l'extrait industriellement par distillation de l' air préalablement liquéfié. Cette méthode de production de l'azote a pour inconvénient de laisser dans le gaz obtenu des impuretés, comme l'oxygène. L'azote spectroscopiquement pur est préparé par décomposition thermique des azotures, sous vide.
L'abondance de l'azote dans l'atmosphère n'est pas étrangère à son rôle essentiel dans la biosphère : chez les êtres vivants, les composés de l'azote, protéines, acides nucléiques, etc., sont des constituants fondamentaux de la matière organique. Du fait de la labilité des structures et des processus vitaux, perpétuellement renouvelés, des modifications incessantes caractérisent les rapports de l'azote atmosphérique et de l'azote intégré dans la biosphère. Des échanges réversibles se produisent continuellement entre l'état organique, macro ou micromoléculaire et l'état minéral représenté par les ions ammonium, nitrite et enfin par l'azote gazeux.
Au total, des transformations continuelles de l'état chimique de l'azote, réalisant un cycle biogéochimique de cet élément, découlent de la présence de la vie sur terre et la conditionnent. L'homme bénéficie directement et indirectement de ces processus. Il intervient dans leur déroulement par son activité agronomique et industrielle : synthèse d'ammoniac et autres composés azotés servant d'engrais, fabrication de produits pharmaceutiques, de colorants... et d'explosifs !
Propriétés
Les numéro et masse atomiques de l'azote sont respectivement 7 et 14,008. Ce gaz a pour températures d'ébullition et de fusion − 195,7 0C et − 210 0C. La dimension de son rayon atomique est d'environ 0,07 nm et son premier potentiel d'ionisation s'élève à 14,5 V. L'azote naturel comprend 99,65 p. 100 d' isotope 14N et 0,35 p. 100 d'isotope 15N. Après enrichissement, celui-ci est souvent utilisé comme traceur.
Structure électronique de l'azote et de ses composés
L' atome d'azote, qui se place en tête de la colonne V du tableau périodique de Mendeleïev, correspond à une configuration 1s22s22p3. Le diagramme de corrélation électronique de la molécule N2 est donc caractérisé par l'occupation des niveaux σ (s), σ⋆(s), σ(pz), π(px) et π(py), à l'exclusion de tout niveau π⋆ ; cette propriété explique que l'enthalpie de dissociation soit élevée (− 170 kcal/mole N2), supérieure en particulier à celles du monoxyde d'azote NO ou de l'oxygène, dont les niveaux π⋆ sont occupés.
Dans ces composés covalents l'azote répond aux types d' hybridation suivants :
sp, avec formation de deux liaisons π ; ex. : l'ion N3- (dN-N = 0,115 nm) ;
sp2, avec une liaison π ; ex. : l'ion NO2-. Dans N3H les deux types d'hybridation apparaissent simultanément (d = 0,114 nm et 0,125 nm) ;
sp3, avec un nombre de « doublets non engagés » qui peut être égal à 0, 1, 2 ou 3 (ex. : la série isoélectronique NH4, NH3, NH2-, NH2-). Ceux-ci confèrent un caractère donneur aux molécules azotées qui les possèdent. Ce caractère donneur est nettement plus marqué que celui des éléments V et VB qui suivent l'azote dans le tableau périodique, pour lesquels le doublet [...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul HAGENMULLER : professeur à la faculté des sciences de Bordeaux, directeur du Laboratoire de chimie du solide au C.N.R.S.
- Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Pour citer cet article
Universalis et Paul HAGENMULLER. AZOTE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
AGRICULTURE - Agriculture et industrialisation
- Écrit par François PAPY
- 7 421 mots
- 3 médias
L'intérêt d'un apport d'azote minéral, même en complément du fumier, est apparu au milieu du xixe siècle. Il était alors appliqué sous forme de nitrate de soude (ou salpêtre) en provenance des déserts arides du Chili. Devant l'engouement pour ce produit, des agronomes s'interrogent, dès... -
AIR
- Écrit par Jean PERROTEY
- 2 154 mots
- 2 médias
...de l'oxygène en excès, la présence d'un résidu non absorbable, ce qui constitue la première mise en évidence de l'argon et des gaz rares de l'air. Jusqu'à la fin du xixe siècle, on distingue deux sortes d'azote, l'azote obtenu par la voie chimique, par décomposition du nitrite d'ammonium : NH... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Lachimie des trois classes d'amines est caractérisée par la présence, sur l'atome d'azote, d'un doublet non partagé qui confère à la molécule des propriétés basiques et une réactivité nucléophile. Les amines primaires et secondaires présentent en outre une réactivité particulière, liée à la présence... -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 033 mots
- 5 médias
...solution aqueuse du gaz ammoniac, fut proposé par Torbern Olof Bergmann. Priestley avait été amené à considérer ce gaz comme un composé d' azote et d'hydrogène ; cela fut confirmé par Claude Louis Berthollet, qui, en 1785, en fit l'analyse et indiqua sa composition ; celle-ci correspond... - Afficher les 26 références
Voir aussi
- BASE, chimie
- ISOTOPES
- MONOXYDE D'AZOTE
- MINÉRALE CHIMIE
- OXYDORÉDUCTION
- DIOXYDE D'AZOTE
- POTENTIEL D'OXYDORÉDUCTION
- ANHYDRIDES
- CYANAMIDE CALCIQUE
- HYBRIDATION DES ORBITALES
- NITRURES
- OXYNITRURES
- NITRITES
- ENDOTHERMIQUE RÉACTION
- AMIDURES
- HYDRAZINE
- DIMÉTHYLHYDRAZINE
- HYDROXYLAMINE
- FULMINANTS
- AZOTHYDRIQUE ACIDE
- AZOTURES
- NITRATE D'AMMONIUM
- OXYDES D'AZOTE
- ÉLECTRONIQUE STRUCTURE
- PROTOXYDE ou HÉMIOXYDE D'AZOTE
- CONFIGURATION ÉLECTRONIQUE
- TRANSITION MÉTAUX DE
- NITREUX ACIDE
- OXYDES