MÉTAUX Vue d'ensemble
Le groupe des métaux rassemble environ soixante-quinze éléments de la table périodique dont il occupe toute la partie gauche. Structurellement, les métaux se définissent comme les éléments comportant moins de quatre électrons sur la couche électronique de valence. Comme ces électrons sont facilement perdus pour former l'octet stable, les métaux se caractérisent fondamentalement comme donneurs d'électrons. De cet aspect de leur comportement électronique découlent leurs propriétés physiques et chimiques.
Les propriétés physiques des métaux se déduisent de la nature de la liaison métallique et du phénomène de délocalisation électronique. Les métaux présentent tous l'éclat métallique sur une coupe fraîche, dû à la réflexion de la lumière sur le nuage d'électrons libres ; à l'exception du mercure, les métaux sont solides à température et à pression normales, en raison de la valeur élevée de l'énergie de la liaison intermétallique ; ils présentent habituellement de bonnes propriétés mécaniques, particulièrement la ductilité, qui tiennent à la souplesse de la liaison métallique ; ce sont de bons conducteurs de la chaleur et de l'électricité, cette conduction étant assurée par des électrons libres du gaz électronique ; enfin, en solution ionisée, les métaux donnent naissance à des cations positifs qui apparaissent à la cathode d'un voltamètre.
L'activité chimique des métaux s'explique de même par le caractère de donneurs d'électrons de ces éléments. Les métaux sont des réducteurs, donc des éléments facilement oxydables, qui se combinent aux métalloïdes pour donner des sels ; ils se combinent facilement avec l'ion hydroxyle OH— pour donner des bases ; enfin, les métaux se combinent à l'hydrogène pour donner des hydrures, la perte d'un électron par le métal conduisant à la formation d'un ion H— non acide.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Pierre LÉVIS : auteur
Classification
Pour citer cet article
Jean-Pierre LÉVIS. MÉTAUX - Vue d'ensemble [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 25/03/2009
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :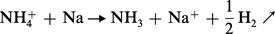
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 636 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références





