ASTROCHIMIE
Chimie du carbone et chaînes carbonées
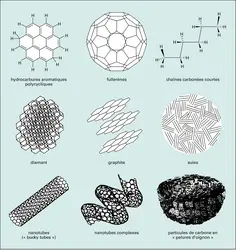
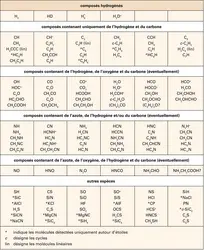
Ce n'est pas un hasard si la plupart des molécules interstellaires contiennent du carbone : il s'agit du quatrième élément chimique en nombre dans l'Univers. C'est aussi le plus « souple » : il se combine facilement aux autres atomes, et de plusieurs façons possibles, pour former de nombreuses molécules. Ces propriétés rendent la chimie du carbone, ou chimie organique, très riche. On la rencontre dans des environnements divers : sur la Terre, où presque tous les organismes vivants se développent sur la chimie du carbone, mais aussi dans des atmosphères planétaires – parmi lesquelles celles de Jupiter, de Saturne et de son satellite Titan –, dans les comètes, dans une classe de météorites (les chondrites carbonées) et enfin, bien sûr, dans le gaz interstellaire. Sauf sur la Terre, les molécules organiques identifiées ne proviennent cependant pas d'organismes vivants. Compte tenu de leur réactivité, des molécules typiques de l'espace interstellaire comme les chaînes et cycles carbonés seraient même tout à fait néfastes à la vie. Comment alors se forment ces étranges molécules organiques ?
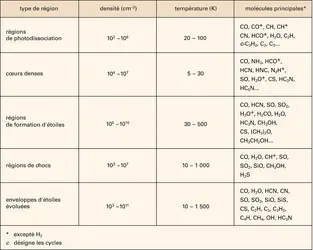
Une partie de la réponse se cache dans la constellation du Taureau. En 1977, on découvrit dans un nuage dense de cette région, baptisé TMC-1 (Taurus Molecular Cloud-1), la molécule de cyanodiacétylène (HC5N). Il s'agissait de la plus grosse molécule interstellaire connue à l'époque. Cette trouvaille focalisa de nombreuses recherches de molécules sur ce nuage, qui se révéla avec le temps d'une grande richesse chimique. TMC-1 abrite la plupart des molécules les plus complexes jamais détectées dans l'espace, dont de nombreuses chaînes carbonées comme les cyanopolyynes (jusqu'à HC11N) ou les chaînes acétyléniques (depuis C2H jusque C8H), ainsi que bien d'autres molécules organiques dont les radicaux cycliques c-C3H et c-C3H2. C'est pourquoi TMC-1 demeure le « laboratoire » préféré des astrochimistes, alors même que certaines de ces molécules sont maintenant observées dans de nombreux nuages interstellaires, depuis les régions les plus froides jusqu'aux nuages diffus. Dans les laboratoires terrestres, ces radicaux et molécules insaturées sont en effet difficiles à isoler, du fait de leur réactivité : leur durée de vie n'y est que d'une fraction de seconde. Au contraire, leur présence dans l'espace démontre qu'ils s'y forment efficacement et s'y maintiennent longtemps (plusieurs centaines de milliers d'années au moins). L'existence de ces molécules ne peut se comprendre que comme un subtil équilibre entre leurs voies de formation et de destruction. Découvrir cet équilibre constitue l'objectif de l'astrochimiste.
Les processus de destruction sont relativement simples. Le plus efficace est la photodissociation par exposition à un rayonnement dans l'ultraviolet lointain. Ce processus devient cependant complètement négligeable dans les régions froides, denses et opaques au rayonnement – comme TMC-1 –, où d'autres mécanismes moins efficaces prennent le relais : l'ionisation et la dissociation par les rayons cosmiques (ces particules énergétiques qui pénètrent au cœur des nuages), la condensation sur les grains de poussière et, bien entendu, la participation aux réactions chimiques (le processus le plus efficace sur Terre, qui explique la durée de vie très courte des chaînes et cycles carbonés hautement réactifs).
Les mécanismes de formation sont plus complexes. Les astrochimistes distinguent deux grandes voies de synthèse : celle qui utilise la phase gazeuse – par des réactions entre molécules, atomes ou ions –, et celle qui se déroule en phase solide, c'est-à-dire à la surface des grains de poussière interstellaire.
Compte tenu de la très basse densité[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- David FOSSÉ : journaliste scientifique
- Maryvonne GERIN : chercheur au Laboratoire d'étude du rayonnement et de la matière en astrophysique (L.E.R.M.A.), C.N.R.S., Observatoire de Paris, École normale supérieure et université de Paris-VI-Pierre-et-Marie-Curie
Classification
Pour citer cet article
David FOSSÉ et Maryvonne GERIN. ASTROCHIMIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALMA (Atacama Large Millimeter/submillimeter Array)
- Écrit par Pierre LÉNA
- 2 129 mots
- 5 médias
La chimie interstellaire est pratiquement née avec la radioastronomie millimétrique dans les années 1980. Avec A.L.M.A., elle entre dans une nouvelle phase, puisque des molécules peuvent être détectées dans tous les types d'objets, en particulier à très grande distance. La complexité des échanges physico-chimiques,... -
COMÈTES
- Écrit par Myriam DÉTRUY
- 4 347 mots
- 7 médias
Les comètes s'étant formées dans des environnements froids, à des températures inférieures à –170 0C, elles ont subi peu de modifications chimiques, sauf à leur surface si elles ont été bombardées par des rayons ultraviolets ou des protons cosmiques. Les plus gros objets ont peut-être... -
ÉTOILES
- Écrit par André BOISCHOT, Jean-Pierre CHIÈZE
- 13 456 mots
- 8 médias
La formation des molécules dans un nuage peut conduire à sa fragmentation. Les molécules ne peuvent se former que lorsque la densité, à la suite de la contraction globale du nuage, a atteint une valeur suffisamment élevée (plusieurs atomes par mètre cube). La formation de molécules comme H... -
INTERSTELLAIRE MILIEU
- Écrit par James LEQUEUX
- 3 696 mots
- 4 médias
...peu ou pas d'hydrogène atomique (détectable par la raie à 21 cm), mais il n'est malheureusement observable que dans des circonstances exceptionnelles. Contrairement à la plupart des autres molécules, celles d'hydrogène ne peuvent se former à partir des atomes d'hydrogène que par catalyse sur les grains.... - Afficher les 7 références
Voir aussi