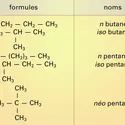
RADICAUX LIBRES
Dans la plupart des molécules organiques, les atomes voisins sont liés les uns aux autres par des liaisons covalentes, c'est-à-dire fondées sur l'appariement naturel des électrons de vecteur magnétique ou « spin » opposé. Lors d'une irradiation, de l'exposition à une source d'énergie lumineuse ou thermique d'intensité suffisante, ou de réactions chimiques d'oxydoréduction, le couple électronique peut être rompu. La molécule ou l'atome se trouve de ce fait porter un ou plusieurs électrons « célibataires » sur son orbitale externe et est désigné sous le terme de « radical libre ». La tendance naturelle des électrons non appariés à interagir avec les électrons de molécules ou d'atomes voisins, pour reformer des liaisons chimiques covalentes, confère aux radicaux libres une très grande instabilité, une extrême réactivité et la capacité de déclencher la néoformation et la propagation en chaîne d'autres espèces radicalaires. C'est ce processus de transfert et de propagation des radicaux libres que l'on désigne parfois sous le terme évocateur de « cascade radicalaire », et qui, au sein de la matière vivante, peut aboutir à la destruction partielle ou complète des structures cellulaires et tissulaires avoisinantes.
Les radicaux libres dérivés de l'oxygène moléculaire
La molécule d'oxygène est à l'état fondamental un biradical puisqu'elle comporte deux électrons célibataires et de spins parallèles sur son orbitale externe. Cette configuration lui confère une très grande stabilité et prévient l'addition directe d'une paire d'électrons (de spins nécessairement opposés), car celle-ci impliquerait une inversion de spin d'un des électrons avant sa liaison. En revanche, et sous réserve d'un apport d'énergie suffisant, la molécule d'oxygène peut aisément acquérir un électron supplémentaire par appariement avec l'un de ses électrons célibataires. Cette réduction monovalente de l'oxygène aboutit à la génération d'une espèce radicalaire simple, l'anion superxoyde (O.-2). Celle-ci peut, en présence d'ions hydrogène H+, céder son électron libre à une autre molécule d'O.-2 et donner ainsi naissance au peroxyde d'hydrogène (ou eau oxygénée, H2O2). Cette réaction, appelée dismutation, peut se réaliser de façon spontanée mais, dans les organismes vivants, elle se produit essentiellement sous l'influence de la catalyse enzymatique de la superoxyde dismutase.
Le peroxyde d'hydrogène ne possède pas d'électrons célibataires et n'est donc pas à proprement parler un radical libre, mais en présence de fer il peut se décomposer et donner naissance à un radical hydroxyle OH. doué d'une extrême réactivité et toxique envers la plupart des structures organiques. OH. et H2O2 peuvent à leur tour se combiner et donner naissance à l'oxygène singulet 1O2. Enfin la molécule d'oxygène native peut elle-même réagir avec des radicaux libres et générer des radicaux peroxyles ROO., espèces hautement toxiques et capables d'initier toute une cascade de réactions radicalaires à partir d'autres structures organiques. C'est cet ensemble de dérivés réduits de l'oxygène O.-2, H2O2, OH., 1O2, ROO. que l'on regroupe sous le terme générique de radicaux oxygénés libres.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Béatrice DESCAMPS-LATSCHA : docteur en médecine, docteur ès sciences, directeur de recherche à l'I.N.S.E.R.M.
Classification
Pour citer cet article
Béatrice DESCAMPS-LATSCHA. RADICAUX LIBRES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCANES
- Écrit par Jacques METZGER
- 3 614 mots
- 11 médias
...pression partielle des hydrocarbures (vapocraquage). Sous l'action de la température se produit la coupure homolytique de liaisons C−C qui conduit à des radicaux libres dont la réaction avec d'autres molécules et d'autres radicaux est responsable de la formation des molécules plus courtes, saturées ou non... -
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 339 mots
- 2 médias
Ces faits s'accordent avec le mécanisme d'une réaction radicalaire en chaîne. Si l'on représente le composé autoxydable par la formule R—H, la liaison covalente entre l'hydrogène et le groupe R résulte de la mise en commun de deux électrons, l'un étant fourni par l'... -
ATHÉROSCLÉROSE
- Écrit par Loïc CAPRON
- 5 353 mots
- 1 média
...l'athérosclérose, la plus vraisemblable aujourd'hui est l'oxydation : l'inflammation est génératrice de petites molécules contenant de l'oxygène activé (radicaux libres), capables d'oxyder les molécules avoisinantes ; l'oxydation des complexes lipidiques présents dans l'intima artérielle (lipoprotéines... -
CINÉTIQUE CHIMIQUE
- Écrit par Lucien SAJUS
- 9 646 mots
- 7 médias
Certainesformes actives résultent de la scission d'une molécule, chaque fragment conservant un électron du couple d'électrons qui assurait la liaison dans la molécule ; c'est une scission homolytique donnant deux radicaux, comportant chacun un électron non apparié. De tels radicaux sont extrêmement... - Afficher les 17 références
Voir aussi