GIBBS JOSIAH WILLARD (1839-1903)
Bien que les exposés de Gibbs se distinguent par une exceptionnelle clarté, et la façon dont l'idée essentielle y est toujours soigneusement dégagée, le premier des deux mémoires n'a guère retenu tout d'abord l'attention des chimistes de son époque, peu accoutumés au langage rigoureux des sciences exactes. La richesse des méthodes thermodynamiques sur lesquelles il s'appuie en a fait cependant une base unifiée de la théorie physico-chimique des états d' équilibre et de leur stabilité. La plupart des lois qui se rapportent à cette discipline, et qui portèrent d'abord d'autres noms, furent redécouvertes ultérieurement au sein de ce premier mémoire. Il en est ainsi, par exemple, de la loi des phases donnant la variance des systèmes en équilibre, longtemps attribuée à Bakkuis Roozeboom ; également des lois dites de Van't Hoff et aussi de Le Chatelier, relatives aux déplacements d'équilibre à température constante et à pression constante. Il en est encore de même, des critères de stabilité de l'équilibre, dont le théorème de modération dit de Braun et Le Chatelier. En bref, la plupart des propriétés qui relèvent à présent de la thermodynamique chimique des états d'équilibre, telles que la pression osmotique, l'influence de la tension superficielle, celle des déformations élastiques, la loi relative à l'entropie des mélanges gazeux et le paradoxe de Gibbs associé, ont ce même mémoire pour origine. Seules les contributions du physicien français Pierre Duhem (1861-1916) présentent une importance comparable dans le même domaine. Dans ses méthodes d'exposition, J. W. Gibbs montre une préférence marquée pour les représentations géométriques plutôt que pour les modèles mécaniques. C'est visiblement cette disposition d'esprit qui l'a conduit à développer, dans deux communications antérieures à la précédente, un exposé complet des diagrammes et des surfaces thermodynamiques qui contribua largement à la diffusion de leur emploi auprès des praticiens. Au diagramme pression-volume de Clapeyron vinrent ainsi s'ajouter une série de représentations variées, telles que le diagramme température-entropie ou enthalpie-entropie, qui offrent fréquemment des avantages de commodité ou de clarté sur le précédent. C'est ainsi que l'intervention du diagramme volume-entropie a permis de remplacer par un triangle l'état triple d'un corps pur, représenté par un simple point dans les axes température-pression. De même, l'étude des processus thermodynamiques, par l'intermédiaire des propriétés géométriques des surfaces, a largement contribué à l'illustration des conditions d'équilibre et de stabilité des phases coexistantes au sein de systèmes à un ou plusieurs constituants. Elle a suscité à cette occasion un large élan de l'école hollandaise, conduite par J. D. Van der Waals (1837-1923), en faveur des représentations graphiques pour l'étude des mélanges physico-chimiques.
Mais, bien au-delà de ces contributions, l'orientation nouvelle prise par la physique au cours du xxe siècle tend à accorder une portée encore beaucoup plus grande à la dernière œuvre de Gibbs évoquée plus haut. Elle lui a valu, en effet, d'être considéré aujourd'hui comme le fondateur de la mécanique statistique des états d'équilibre et comme un guide pour ses développements ultérieurs dans le domaine du non-équilibre. Quoique conçue en vue d'aboutir finalement à la justification des lois de la thermodynamique, la théorie de Gibbs fut orientée, dès le début, à l'écart de toute hypothèse sur la constitution de la matière. La préoccupation majeure de l'auteur visait essentiellement à l'élaboration séparée d'une théorie mécanique rigoureuse des systèmes, possédant un très grand nombre de degrés de liberté, débarrassée[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul GLANSDORFF : professeur émérite de la faculté des sciences à l'université de Bruxelles, président d'honneur de l'Institut international du froid, membre de l'Académie royale
Classification
Pour citer cet article
Paul GLANSDORFF. GIBBS JOSIAH WILLARD (1839-1903) [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
...non tensio-actifs, par opposition aux précédents). La relation entre l'enrichissement (ou l'appauvrissement) Γ en surface, la tension superficielle σ et la concentration c est donnée par une relation simple due à J. W. Gibbs (1878) :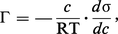
-
LE CHATELIER HENRY (1850-1936)
- Écrit par Georges KAYAS
- 287 mots
Chimiste français né à Paris et mort à Miribel-les-Échelles (Isère). Élève de l'École polytechnique, puis de l'École des mines, Henry Le Chatelier travaille deux ans comme ingénieur avant d'être nommé professeur de chimie générale à l'École des mines, en 1877. Il y enseigne cette matière jusqu'en...
-
MATIÈRE (physique) - États de la matière
- Écrit par Vincent FLEURY
- 5 805 mots
- 4 médias
...le refroidit : au point de solidification, les variables mécaniques décrivant l'état de la matière (la viscosité, par exemple) changent brutalement. Josiah W. Gibbs (1839-1903) reconnaît et énonce la règle des phases : les trois états, solide, liquide et gazeux ne coexistent qu'en un point unique de... -
SYSTÈMES OUVERTS, thermodynamique
- Écrit par Paul GLANSDORFF
- 1 675 mots
On attribue volontiers en physique le nom de système au modèle stylisé d'un milieu naturel en vue de simplifier son étude théorique. Le solide strictement indéformable, le fluide incompressible et le gaz parfait sont des exemples classiques de tels systèmes.
En particulier,...
- Afficher les 7 références
Voir aussi