SYSTÈMES OUVERTS, thermodynamique
On attribue volontiers en physique le nom de système au modèle stylisé d'un milieu naturel en vue de simplifier son étude théorique. Le solide strictement indéformable, le fluide incompressible et le gaz parfait sont des exemples classiques de tels systèmes.
En particulier, un système fermé désigne une portion invariable de matière ou, de la même façon, un ensemble donné de points matériels. Dans tous ces cas, les seuls échanges possibles avec l'environnement extérieur sont de nature énergétique. En leur absence, le système fermé est réputé isolé.
En revanche, tout échange de matière avec le milieu extérieur est le propre d'un système ouvert. Par exemple, une masse de fluide en voie de condensation représente un système fermé, mais chacune des phases considérée séparément est un système ouvert, puisque la masse de liquide croît aux dépens de la masse de vapeur.
L'utilité d'une semblable représentation s'est imposée progressivement, tant en mécanique des fluides avec l'étude des appareils à jets, des fusées et des turboréacteurs, qu'en thermodynamique, avec celle d'un grand nombre de processus physico-chimiques continus, dont notamment les mécanismes du type réaction-diffusion et le comportement de phases superficielles non autonomes. De plus, toute tentative d'interprétation de l'ordre biologique à partir des lois de la thermodynamique pose a priori un problème de système ouvert. Dans cette discipline, l'interprétation de systèmes à masses variables n'est pas récente, puisqu'elle apparaît déjà, au moins tacitement, dans l'œuvre de J. W. Gibbs sur l'équilibre des systèmes chimiques hétérogènes (Equilibrium of Non-Homogeneous Substances. Collected Works, Longmans Green, Londres, 1875-1878). Toutefois, la formulation explicite des bilans de conservation de la masse de chaque constituant, de la quantité de mouvement, de l'énergie interne ou totale (premier principe), comme celle du bilan entropique (second principe), qui régissent les différents flux d'échange entre un système ouvert et son environnement extérieur, n'intervient que beaucoup plus tard à la suite des travaux de l'école de Bruxelles, après 1930. La dénomination actuellement consacrée de système ouvert a la même origine.
Il convient de rappeler à ce sujet que, sous leur forme ordinaire, les théorèmes généraux de la mécanique comme les principes de la thermodynamique se rapportent essentiellement à des systèmes fermés. Pour en déduire la formulation appropriée aux systèmes ouverts, quelques précautions doivent être prises et quelques précisions s'imposent. Tout d'abord, la frontière de ces derniers doit être constituée d'une surface géométrique distincte en tout point de toute limite de séparation entre deux phases afin d'éviter une équivoque sur l'état de la matière qui franchit cette frontière, et l'ambiguïté qui en résulterait pour la définition même du système ouvert considéré.
C'est ainsi que dans l'exemple cité relatif à la condensation d'une vapeur, la frontière du système ouvert est située dans la phase liquide, car elle doit incorporer, en outre, la couche de transition vapeur-liquide. La phase liquide peut se présenter sous forme continue ou dispersée en brouillard. Dans ce cas, la masse M du système obéit aux égalités :
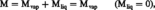
et son accroissement dM a pour valeur :
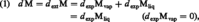
où l'indice ext. désigne l'échange externe avec le milieu ambiant.
Bien entendu, la convention inverse qui revient à incorporer la couche de transition à la phase liquide, ce qui implique l'état de vapeur sur la face externe de la frontière, est pareillement acceptable, mais le choix doit être précisé dans chaque cas. Ce commentaire justifie aussi la dénomination de controled volume, adoptée[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul GLANSDORFF : professeur émérite de la faculté des sciences à l'université de Bruxelles, président d'honneur de l'Institut international du froid, membre de l'Académie royale
Classification
Pour citer cet article
Paul GLANSDORFF. SYSTÈMES OUVERTS, thermodynamique [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Autres références
-
STATISTIQUE THERMODYNAMIQUE
- Écrit par Alkiviadis GRECOS
- 4 186 mots
Examinons maintenant le cas des systèmes ouverts, c'est-à-dire des systèmes en interaction avec un réservoir thermique (un thermostat). Leur évolution n'est pas déterminée par leur hamiltonien ni caractérisée par un groupe unitaire. D'un point de vue phénoménologique, on postule alors que l'évolution... -
THERMODYNAMIQUE - Processus irréversibles non linéaires
- Écrit par Agnès BABLOYANTZ , Paul GLANSDORFF , Albert GOLDBETER , Grégoire NICOLIS et Ilya PRIGOGINE
- 9 741 mots
- 8 médias
Les systèmes biologiques sont des systèmes ouverts échangeant de la matière et de l'énergie avec le monde extérieur. Ils se caractérisent par un ordre spatial et temporel tout comme celui des structures dissipatives définies plus haut. Il convient donc d'examiner dans quelle mesure celles-ci interviennent... -
VITALISME
- Écrit par Marie-Christine MAUREL
- 3 768 mots
- 5 médias
...manière de raisonner et de comprendre comment, à partir des premières synthèses prébiotiques, ont pu émerger certaines formes d'organisation des molécules. Pour Ilya Prigogine, un système vivant est un système ouvert qui échange continuellement matière et énergie avec son environnement. Il est le siège d'entrées...


