MOLÉCULE
La stabilité des molécules et les isomères
Constituée d'un ensemble de noyaux positifs autour desquels vont s'organiser les électrons apportés par les atomes de départ, la molécule, dont la stabilité va résulter de forces électromagnétiques décrites comme dans le cas des atomes par la mécanique quantique (cf. liaisons chimiques), apparaît donc comme la généralisation de l'atome. Strictement parlant, la notion d'atomes dans les molécules perd donc son sens. Une molécule est donc formée non pas d'atomes liés entre eux, mais à partir d'atomes. C'est le sens qu'il faut attribuer aux formules qu'écrit le chimiste. Par exemple, H2O pour l'eau signifie que la molécule est construite à partir de deux atomes d'hydrogène représentés chacun par le symbole H et par un atome d'oxygène, représenté par le symbole O. En fait, dans le langage courant, la distinction n'est pas faite et on parle des atomes dans les molécules, comme s'ils avaient conservé leur individualité.
Nous avons dit que le nombre d'espèces de noyaux est borné. Pour les molécules, en revanche, aucune limite n'apparaît, ni pour la diversité des édifices obtenus, ni pour leur taille. La chimie organique, avec ses polymères, et surtout la chimie biologique, avec l'ADN par exemple, nous offrent des exemples d'édifices formés à partir de dizaines de milliers d'atomes.
Une question se pose toutefois à propos de la « forme » des molécules. En effet, à l'échelle macroscopique, la notion de forme d'un objet est étroitement liée à la continuité apparente de la matière qui le constitue. Or, ici, nous sommes dans le domaine du discontinu, de sorte qu'il n'est pas possible de définir un contour.
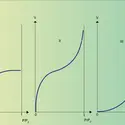
Fort heureusement, le fait que les noyaux sont des milliers de fois plus lourds que les électrons permet une autre approche du problème. En effet, en raison de leur masse très élevée, leur vitesse de déplacement est pratiquement négligeable devant celles des électrons, de sorte qu'on peut pour chaque position des noyaux définir l'énergie totale de la molécule comme somme de l'énergie des électrons dans le champ des noyaux fixes et de l'énergie de répulsion entre les noyaux. Si n est le nombre de noyaux, on pourra construire une hypersurface à 3n dimensions donnant l'énergie totale de la molécule en fonction des coordonnées des noyaux. Cette hypersurface possédera en général un ou plusieurs minimums d'énergie. À chacun d'eux va correspondre une disposition localement stable des noyaux avec leur cortège d'électrons, c'est-à-dire à une molécule au sens où nous l'avons définie. À la notion de forme de la molécule, on doit substituer celle de configuration de ses noyaux. Par exemple, pour le méthane, CH4, les noyaux d'hydrogène sont situés aux sommets d'un tétraèdre régulier et celui de carbone au centre du tétraèdre, les quatre distances C–H étant les mêmes : 0,109 nanomètre (nm ; 1 nm = 10—9 m). En fait, la masse des noyaux n'est pas infinie, de sorte qu'ils sont animés de mouvement d'oscillation autour de chaque minimum. Il vaudrait donc mieux parler de configuration moyenne pour l'ensemble des noyaux.
Si l'hypersurface présente plusieurs minimums énergétiquement bien séparés, à chacun d'eux correspond une molécule. Les diverses molécules ainsi définies possèdent la même formule brute et sont dites isomères. La série des sucres nous offre de très nombreux cas d'isomérie. Par exemple avec le glucose, le fructose ou le mannose qui répondent tous trois à la même formule brute C6H12O6 (cf. glucides). Parmi les hydrocarbures, on peut citer le naphtalène et l'azulène de même formule C10H8.
Si le col à franchir entre deux minimums est suffisamment peu élevé (au-dessous[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Pour citer cet article
André JULG. MOLÉCULE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Autres références
-
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES, Rémi JULLIEN
- 1 616 mots
- 7 médias
...physiques utilisées, la spectrométrie de masse est la plus importante. Elle permet en effet de classer les agrégats selon le nombre N d'atomes ou de molécules qu'ils contiennent. Ainsi, les spectres de masses, pour certaines valeurs de N appelées « nombres magiques », font apparaître que les agrégats... -
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD, Jérôme RANDON
- 8 885 mots
- 4 médias
« C'est dans les cas situés au-delà de la règle que le talent de l'analyste se manifeste. L'important, le principal est de savoir ce qu'il faut observer. » Edgar Allan Poe (Histoires extraordinaires, 1844)
La chimie analytique est la branche de la chimie qui a pour but l'identification,...
-
AROMATICITÉ
- Écrit par André JULG
- 4 706 mots
- 2 médias
...dernier cas, correspondant à des valeurs de spin opposées. Enfin le carré du module de la fonction d'onde donne la densité électronique en chaque point. Le problème de la molécule ne diffère de celui de l'atome que par le fait que la charge positive, autour de laquelle gravitent les électrons, n'est... - Afficher les 83 références
Voir aussi
- IONS
- HYDROGÈNE LIAISON
- ISOTOPES
- NOYAU ATOMIQUE
- LIQUIDE ÉTAT
- SURFACE DE POTENTIEL, chimie quantique
- VIBRATION MOLÉCULAIRE ÉNERGIE DE
- CHARGE ÉLECTRIQUE
- SOLVATATION
- NUCLÉONS
- CRISTAL MACROMOLÉCULAIRE
- HYPERSURFACE DE POTENTIEL, chimie quantique
- CHLORURE DE SODIUM
- PAIRES D'ÉLECTRONS MODÈLE DES, chimie
- CONFIGURATION MOLÉCULAIRE
- AMORPHE ÉTAT
- MONOCRISTAUX
- CRISTAL MOLÉCULAIRE
- GAZEUX ÉTAT
- TEMPÉRATURE
- ÉLECTRONIQUE STRUCTURE
- SOLIDE ÉTAT
- DENSITÉ ÉLECTRONIQUE
- QUARTZ