ADSORPTION
L'adsorption est le phénomène qui consiste en l'accumulation d'une substance à l'interface entre deux phases (gaz-solide, gaz-liquide, liquide-solide, liquide-liquide, solide-solide). Il a son origine dans les forces d'attraction intermoléculaires, de nature et d'intensité variées, qui sont responsables de la cohésion des phases condensées, liquides ou solides. Une molécule attirée inégalement par les autres molécules de deux phases trouvera une position énergétiquement favorable à la surface de la phase qui l'attire le plus ; celle-ci sera appelée l'adsorbant, les molécules ainsi adsorbées constituant l'adsorbat. Si les conditions énergétiques ou cinétiques permettent à la molécule de pénétrer au sein de la phase adsorbante, il y a absorption.
Les cristaux constituent des édifices suffisamment rigides et stables pour que, le plus souvent, les molécules adsorbées ne modifient pas leur structure en surface : on s'intéressera alors surtout aux propriétés des molécules à l'état adsorbé. Par contre, la manifestation essentielle de l'adsorption à la surface des liquides est de modifier leur tension superficielle. Bien que les phénomènes fondamentaux soient les mêmes, l'adsorption se manifeste différemment sur les solides et sur les liquides ; les méthodes d'étude et les domaines d'application sont différents et justifient des traitements distincts.
Adsorption gaz-solide
L'adsorption d'un gaz par un solide peut être mise en évidence expérimentalement d'autant plus facilement que l'aire de sa surface a été multipliée par son état de division. Si un solide cubique de 1 cm d'arête est divisé en petits cubes de 10 nm, l'aire de sa surface sera de 600 m2 et, si l'arête comprend une vingtaine de molécules, environ le quart des molécules du solide seront des molécules de surface. De tels états de division sont le plus souvent instables (ils sont thermodynamiquement métastables), mais on peut préparer facilement des charbons actifs dont l'aire spécifique peut être estimée à plus de 1 000 m2/g. L'aptitude du charbon de bois à retenir des gaz fut reconnue il y a plus de deux siècles.
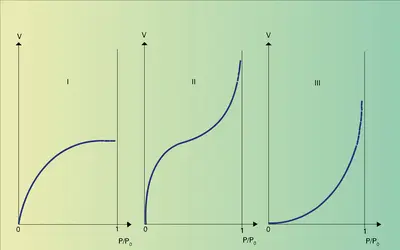
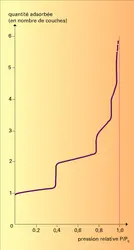
Pour connaître la quantité adsorbée, le plus facile est de mesurer soit la quantité d'adsorbat qui disparaît de la phase gazeuse, soit l'accroissement de masse de l'adsorbant. Pour un couple adsorbant-adsorbat donné, cette quantité dépend de la température et de la pression, et on représente des isothermes d'adsorption en portant la quantité adsorbée à l'équilibre en fonction de la pression à température constante. D'autre part, la nature, l'état et la quantité des molécules adsorbées peuvent être étudiés actuellement par des méthodes analytiques très fines et très élaborées.
À partir d'isothermes d'adsorption à différentes températures, on peut déduire par une relation thermodynamique simple la variation d'énergie des molécules lors de leur passage de l'état gazeux à l'état adsorbé. On constate qu'en règle générale l'adsorption est exothermique (libérant la chaleur d'adsorption). D'après la règle de Le Châtelier, la quantité adsorbée à l'équilibre doit donc croître avec l'abaissement de la température ou avec l'augmentation de la pression. Dans certains cas, la quantité adsorbée est limitée et plus faible à basse température, lorsqu'on atteint les conditions de condensation massive de l'adsorbat, c'est-à-dire sa pression de vapeur.
La seule détermination des isothermes d'adsorption fournit quelques critères qui permettent, le plus souvent, de classer les adsorptions gaz-solide en deux catégories selon la nature des interactions qui retiennent l'adsorbat à la surface. S'il s'agit des forces physiques (forces[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Xavier DUVAL : professeur à l'université de Nancy-I
Classification
Pour citer cet article
Xavier DUVAL. ADSORPTION [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ABSORPTION VÉGÉTALE
- Écrit par René HELLER, Jean-Pierre RONA
- 4 440 mots
- 6 médias
...ions ainsi constituée, est un facteur très important dans la nutrition des plantes : alors que les ions dissous risquent d'être entraînés par les pluies, les ions adsorbés résistent au lessivage et ne sont libérés qu'au fur et à mesure des besoins de la plante. Les anions, comme NO3—, qui ne... -
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD, Jérôme RANDON
- 8 885 mots
- 4 médias
Une phase solide peut être utilisée pour séparer un soluté d'une phase liquide. L'extraction liquide-solide utilise la réaction physico-chimique d'adsorption. Le soluté se fixe alors sur la surface solide de l'adsorbant. Le charbon actif, ou noir de carbone, est très utilisé pour extraire... -
CATALYSE
- Écrit par Henri Jean-Marie DOU, Jean-Eugène GERMAIN
- 8 394 mots
- 7 médias
...semblable à lui-même, capable de poursuivre indéfiniment le même effet. » Ce point de vue était opposé à l'explication dite « physique » de la catalyse par l' adsorption dans les pores du solide, qui provoquerait une concentration locale élevée de réactifs. Nous savons maintenant que les phénomènes d'adsorption... -
CHROMATOGRAPHIE
- Écrit par Robert ROSSET, Louis SAVIDAN, Alain TCHAPLA
- 17 040 mots
- 8 médias
...l'espace le plus restreint possible. Soient respectivement α et β les fractions de A et B qui se trouvent en phase liquide à la température de l'expérience. Celles qui sont adsorbées sur la phase stationnaire sont alors 1 — α et 1 — β. Pour que A soit séparé de B, il faut que les rapports de distribution 1 — α/α... - Afficher les 14 références
Voir aussi