VALENCE, chimie
Valence et coordinence
Alors que la thèse de la polyatomicité était universellement reconnue, après la mort de Kekulé, et figurait comme argument fondamental dans les systèmes chimiques de la fin du xixe siècle, les conceptions d' Alfred Werner allaient bouleverser l'ordre des constats précédemment élaborés. Dans ses Neuere Anschauungen de 1905, Werner observe que « les faits de la chimie inorganique nous convainquent constamment qu'aucune représentation adéquate de la structure des composés inorganiques ne peut être dérivée de la théorie de valence développée à partir de la constitution des corps organiques ». S'attachant à l'étude de ce que l'on appellera des « complexes de coordination », Werner découvre un type d'affinité chimique dont ne rendait pas compte la théorie élémentaire de la valence. Ses conceptions supposaient, au demeurant, deux corps de théorie préalables : la conception stéréochimique de la valence entendue comme propriété directionnelle et la dissociation ionique mise en évidence par Arrhenius, qui implique l'idée d'électrovalence.
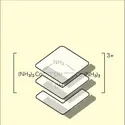
Dès 1893, à la suite de ses investigations sur les amines du chlorure de cobalt, Werner est conduit à distinguer la valence et le nombre de coordination. La valence est, pour lui, le « nombre maximum d'atomes univalents qui, en l'absence d'autres atomes, se combinent directement avec un atome donné ». Quant au nombre de coordination, c'est dans ses vues « le nombre maximum d'atomes ou de groupes d'atomes susceptibles de se combiner directement avec un atome donné ». En construisant des modèles de « composés moléculaires », stables et dissymétriques, autour d'un atome central de métal, Werner instituait l'important chapitre de la chimie des complexes tout en dirigeant l'attention des chimistes sur l'opportunité d'un travail théorique sur la nature de la liaison chimique, dont les modalités apparaissaient de plus en plus complexes.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques GUILLERME : chargé de recherche au C.N.R.S.
Classification
Pour citer cet article
Jacques GUILLERME. VALENCE, chimie [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ATOME
- Écrit par José LEITE LOPES
- 9 140 mots
- 13 médias
...sont couplés de telle façon que leurs spins sont antiparallèles. On dit que ces spins sont saturés. De cette façon, l'on comprend la définition de lavalence d'un atome ou d'une molécule comme le nombre d'électrons dont le spin n'est pas saturé. C'est pourquoi les gaz rares ont une valence nulle. -
CHIMIE - Histoire
- Écrit par Élisabeth GORDON, Jacques GUILLERME, Raymond MAUREL
- 11 186 mots
- 7 médias
...principaux concepts opératoires d'une théorie des structures et des associations atomiques. C'est alors que se déploie l'histoire du concept variable de valence qui règle les rapports arithmétiques puis topologiques des atomes dans les molécules puis dans leurs associations. Cependant, le tableau des éléments... -
COMPLEXES, chimie
- Écrit par René-Antoine PARIS, Jean-Pierre SCHARFF
- 4 304 mots
- 5 médias
...liés à l'ion métallique définit le nombre de coordination de l'atome métallique central. Un métal peut présenter plusieurs nombres de coordination caractéristiques de la valence de l'atome central ou de la nature du coordinat envisagé. La notion de nombre de coordination est différente dans le cas... -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL, Jean-Pierre SCHARFF
- 4 894 mots
- 4 médias
...le nombre total des électrons entourant l'atome central compte tenu des doublets mis en commun ; si Z est le numéro atomique de l'atome central, V la valeur algébrique de la valence de l'ion correspondant, et C la coordinence, on a : Zeff = Z − V + 2C. Par exemple, pour le... - Afficher les 14 références
Voir aussi