TANTALE ET NIOBIUM
Propriétés
Propriétés physiques
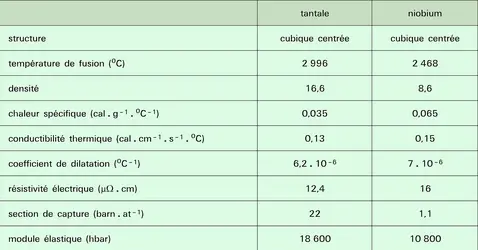
Le tantale a pour numéro atomique 73 et pour poids atomique 180,95. Ses propriétés physiques marquantes sont portées dans le tableau 2. Le cristal est cubique centré, de paramètre a = 3,296 ; il n'y a aucune transformation allotropique. Il faut enfin signaler une propriété extrêmement importante : la valeur très élevée (de l'ordre de 25 à 28) de la constante diélectrique de l'oxyde de tantale.
Le niobium a pour numéro atomique 41. Son poids atomique est de 92,91. Le tableau 2 rassemble ses principales propriétés physiques. Le cristal est cubique centré à toutes températures (pas de transformation allotropique). La section de capture des neutrons thermiques est faible : 1,1 barn/atome, à comparer, d'une part, avec celle du béryllium (0,009), du magnésium (0,06), du zirconium (0,18), de l'aluminium (0,23) et, d'autre part, du fer et des aciers (2 à 3), du tantale (22).
Du point de vue de la résistivité électrique, la température de transition en dessous de laquelle le métal devient supraconducteur (c'est-à-dire prend une résistivité nulle) est de 9,2 K (température la plus élevée des métaux purs), avec, toutefois, un champ critique relativement faible (0,25 T), ce qui est le cas de tous les métaux purs.
Enfin, comme l'oxyde de tantale, l'oxyde de niobium a une constante diélectrique élevée (de l'ordre de 20 à 25).
Propriétés chimiques
Les deux métaux ont un comportement très voisin avec deux traits dominants : une grande réactivité vis-à-vis des gaz à partir d'une température modestement élevée et une passivité exceptionnelle dans un grand nombre de milieux chimiques agressifs.
Réaction avec les gaz
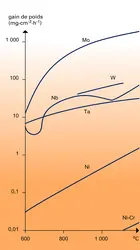
Dans l'air sec ou humide et à température ambiante, les deux métaux restent parfaitement inertes. Dès que la température s'élève, et ce à partir de 200 à 300 0C, on constate une attaque se développant de deux façons : contamination par diffusion de l'oxygène vers l'intérieur ; formation d'une couche d'oxyde fragile et à forte augmentation de volume. Cette couche d'oxyde se forme au-dessus du métal et le consomme plus ou moins rapidement. La figure 1 montre, de ce point de vue, les positions relatives du tantale et du niobium par rapport à d'autres métaux.
L' hydrogène diffuse et se solubilise dans les deux métaux à partir de 100 0C. La vitesse de réaction croît avec la température, devient notable dès 300 0C et très rapide entre 600 et 800 0C, transformant tout le métal en hydrure extrêmement fragile. L'hydrogène est facilement éliminé par traitement entre 800 et 1 200 0C sous vide. Cette fragilisation par l'hydrogène est un risque grave latent dans la fabrication et l'utilisation. Tout particulièrement pour les emplois en milieux corrosifs, on évitera très soigneusement de provoquer une formation d'hydrogène naissant au voisinage du tantale et du niobium et, par exemple, les contacts avec le graphite ou des métaux tels que le fer, l'aluminium, le zinc par rapport auxquels le tantale ou le niobium sont cathodiques.
La plupart des autres gaz (ammoniac, gaz de combustion, CO, CO2) réagissent avec les deux métaux à plus ou moins haute température.
Jusqu'à 200 0C, l'eau et la vapeur d'eau n'ont aucune action, ni corrosive ni fragilisante, à condition bien sûr que tout autre gaz soit éliminé et aussi que le pH soit maintenu inférieur à 8. Au-delà de 200 0C, on constate une détérioration progressive de la tenue par suite d'une fragilisation par l'hydrogène.
Réaction avec les milieux chimiques
En résumé, on peut dire que le tantale résiste parfaitement, jusqu'à des températures de 180 à 200 0C, à tous les milieux acides ou neutres, aussi complexes qu'on puisse les imaginer, avec les exceptions suivantes : présence d'acide[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Robert SYRE : ingénieur des Arts et Manufactures
Classification
Pour citer cet article
Robert SYRE. TANTALE ET NIOBIUM [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
COLOMBITE-TANTALITE
- Écrit par Yannick LOZAC'H
- 294 mots
La tantalite, (Fe,Mn)Ta2O6, et la colombite (on écrit aussi columbite), ou niobite (Fe,Mn)Nb2O6 constituent une série de mélanges minéraux isomorphes : les colombo-tantalites. Les teneurs en colombo-tantalates, ou niobo-tantalates, et en ferromagnésiens varient beaucoup, et même à l'intérieur...
-
ÉTAIN
- Écrit par Claude FOUASSIER, Michel PÉREYRE
- 3 378 mots
Signalons enfin la propriété remarquable de l'alliage niobium-étain, Nb3Sn, d'être un supraconducteur jusqu'à une température de 18,1 K. On envisage d'utiliser ce matériau pour la fabrication de lignes haute tension, maintenues à la température de l'hélium liquide, qui distribueraient le courant sans...
Voir aussi