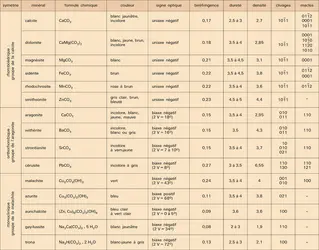
CARBONATES
Minéraux du groupe de l'aragonite
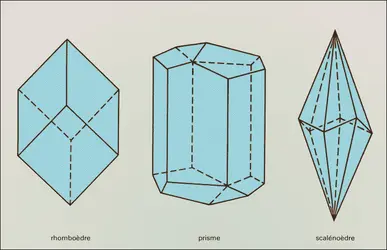
La structure de ces carbonates est orthorhombique. Dans l'aragonite, chaque ion calcium est coordiné à 9 ions oxygène, et chaque ion oxygène à 3 ions calcium. La coordinance 9 est caractéristique du groupe. Les ions calcium ont un arrangement approximativement hexagonal compact, qui donne naissance à une symétrie pseudo-hexagonale très marquée. Cela se reflète dans la macle pseudo-hexagonale qui est caractéristique de tous les membres du groupe. Les formes minéralogiques les plus fréquentes sont les formes pyramidale aciculaire, tabulaire, prismatique hexagonale, cette dernière résultant de l'intercroissance de trois individus maclés suivant la face du prisme, et dont les plans de base sont mis en commun.
Aragonite
Le nom de ce minéral vient de l'Aragon, où la macle pseudo-hexagonale de l'aragonite fut observée pour la première fois.
L'aragonite a la même composition que la calcite. La substitution du strontium au calcium connaît seule une importance notable, les rayons ioniques de ces deux éléments étant très voisins.
L'aragonite précipite facilement à partir de solutions aqueuses de bicarbonate de calcium. En milieu marin, elle est généralement le carbonate de calcium chimiquement précipité. Bien que ce minéral soit métastable à température et pression ordinaires, sa transformation en calcite est alors très lente, les ions Mg2+ et SO24— de l'océan jouant le rôle de stabilisateurs vis-à-vis de l'aragonite. La courbe d'analyse thermique différentielle montre que la transformation de l'aragonite en calcite se traduit par un léger pic endothermique vers 450 0C, tandis que la décomposition du carbonate de calcium a lieu autour de 950 0C.
Souvent incolore, mais pouvant prendre des teintes variées sous l'effet de diverses impuretés, l'aragonite se distingue de la calcite par son poids spécifique supérieur et l'absence de clivage rhomboédrique. La réaction de Meigen est utilisée comme test chimique : quelques grains ou une poudre du minéral sont mis dans une solution de Co(NO3)2 portée à ébullition pendant quelques minutes. Rapidement, il apparaît une coloration lilas ou violette sur l'aragonite, alors que la calcite reste incolore ou devient légèrement bleue après une ébullition prolongée.
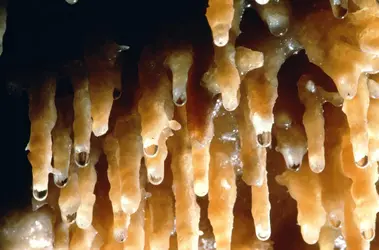
L'aragonite, moins stable que la calcite, est beaucoup moins fréquente que cette dernière. Elle constitue cependant la coquille de nombreux Lamellibranches et les tests de Céphalopodes ; elle est le constituant normal des perles, du corail... L'aragonite précipitée à partir de l'eau de mer donne naissance à des boues calcaires, certaines conditions hydrodynamiques peuvent même favoriser la formation d'oolithes. En pays calcaire, les stalactites des grottes et cavernes sont parfois constitués d'aragonite. Elle est, d'autre part, souvent associée au gypse dans certaines marnes et argiles. Elle peut apparaître également dans la zone d'oxydation des minerais sulfurés, où elle accompagne la calcite, la limonite et la malachite. Dans les roches volcaniques, andésites et basaltes, l'aragonite peut être un minéral secondaire qui apparaît dans de petites cavités. De beaux cristaux présentant la macle pseudo-hexagonale ont été trouvés à Molina (Aragon) en Espagne, à Bastennes dans le sud de la France, à Girgenti en Sicile.
Withérite
Le nom de ce minéral a été dédié à Withering, qui le découvrit et l'analysa pour la première fois, à la fin du xviiie siècle. Sa structure est semblable à celle de l'aragonite. Les cristaux, toujours maclés sur (110), prenant la forme de pyramides pseudo-hexagonales dues à l'intercroissance de trois individus, sont généralement incolores, blancs ou gris, selon que le minéral est pur ou que de petites quantités de calcium et de strontium se sont substituées au baryum. La courbe[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Marc DARDENNE : docteur en géologie
- André JAUZEIN : professeur à la faculté des sciences de l'université de Paris-VI-Pierre-et-Marie-Curie, directeur du laboratoire de géologie de l'École normale supérieure de Paris
Classification
Pour citer cet article
Marc DARDENNE et André JAUZEIN. CARBONATES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
BARYUM
- Écrit par Bernard CARTON
- 330 mots
Du grec barus, lourd
Symbole chimique : Ba
Numéro atomique : 56
Masse atomique : 137,34 g
Point de fusion : 725 0C
Point d'ébullition : 1 640 0C
Densité (à 20 0C) : 3,5.
Deuxième membre de la famille des alcalinoterreux (après le calcium), dont C. W. Scheele découvrit la base (baryte)...
-
BÉRYLLIUM
- Écrit par Jean-Paul CARRON, Robert GADEAU, Jean PERROTEY
- 5 410 mots
- 5 médias
Le carbonate basique sert d'intermédiaire dans la préparation des autres sels. Les solutions de glucine, dans le carbonate d'ammonium, portées à l'ébullition après dilution, laissent déposer un produit de composition variable, amorphe aux rayons X et contenant de 2 à 5 molécules d'hydroxyde pour une de... -
CALCAIRES
- Écrit par Charles POMEROL
- 5 177 mots
- 8 médias
Une roche est dite calcaire si elle renferme au moins 50 p. 100 de carbonate de chaux (CaCO3), généralement représenté par de la calcite, plus rarement par de l'aragonite ; les minéraux les plus fréquemment associés au carbonate de chaux dans les roches calcaires sont la dolomite, CaMg(CO...
-
CALCIUM
- Écrit par Jean PERROTEY
- 2 292 mots
- 2 médias
Le calcium, élément chimique de symbole Ca et de numéro atomique 20, est le plus léger des métaux alcalinoterreux vrais. Il représente environ 3,45 p. 100 du poids de la croûte terrestre et se classe, par ordre d'abondance, au troisième rang des métaux, derrière l'aluminium et...
- Afficher les 20 références
Voir aussi
- AURICHALCITE
- ANKÉRITE
- BREUNÉRITE
- CARBONATE ION
- RHODOCHROSITE ou DIALOGITE
- STALAGMITES & STALACTITES
- SIDÉRITE ou SIDÉROSE ou FER SPATHIQUE, minéralogie
- SPHÉROSIDÉRITE
- SMITHSONITE
- WHITÉRITE
- STRONTIANITE
- CÉRUSITE
- HYDROMAGNÉSITE
- LANSFORDITE
- MEIGEN RÉACTION DE
- NESQUEHONITE
- CALCITE
- ARAGONITE
- DOLOMITE
- BASTNAÉSITE
- DOLOMIES
- NATRON
- SPATH D'ISLANDE
- MAGNÉSITE
- DOLOMITES
- SÉDIMENTAIRES ROCHES
- MINÉRAUX
- DOLOMITISATION
- RÉCIFS
- HYDROZINCITE
- CYCLE GÉOCHIMIQUE
- CARBONATE DE CALCIUM