ÉLECTROCHIMIE
L'électrochimie décrit les relations mutuelles de la chimie et de l'électricité ou, mieux, des phénomènes couplés à des échanges d'énergie électrique. Ainsi, la presque totalité de la chimie, du fait de l'importance de la distribution et de la variation des charges électriques dans la matière, peut relever peu ou prou de l'électrochimie.
Prise au sens le plus large, cette science ne peut apparaître comme une discipline spécialisée. Elle est de plus en plus de nature interdisciplinaire et comprend les transferts d'électrons à travers les membranes en chimie et en biologie, la formation et le comportement des matériaux, le stockage de l'énergie, les sciences de l'ingénieur, la synthèse, etc. En d'autres mots, la connaissance de l'électrochimie sera nécessaire à la compréhension des phénomènes à l'intérieur de phases le plus souvent à conduction ionique et des interphases qui leur sont associées.
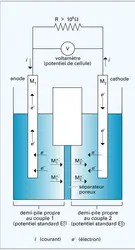
L'électrolyse apparaît, quant à elle, comme la mise en œuvre d'une réaction non favorisée sur le plan thermodynamique et impliquant le transfert d'électrons au moyen d'un courant électrique. Dans ces conditions, une cellule d'électrolyse – ou électrolyseur – peut être considérée comme équivalente à une pile mais, dans ce cas, le courant est inversé à l'aide d'un générateur externe.
Électrochimie cinétique et électrochimie ionique
Classiquement, on convient de scinder l'électrochimie en deux sous-disciplines apparemment distinctes. Tout d'abord, l'électrochimie peut décrire les phénomènes de transport de charge et de matière ainsi que les réactions chimiques associées à une interface entre un conducteur ionique et un conducteur électronique. Cela constitue l'électrochimie dite aux électrodes ou électrochimie cinétique. Le potentiel électrique pris ou imposé à chacune des électrodes implique vis-à-vis de l'électrolyte et des produits chimiques ou ions associés des transferts de charge ou d'électron. Ce transfert de charge provoque donc, ipso facto, une perturbation de la nature chimique de l'interface.
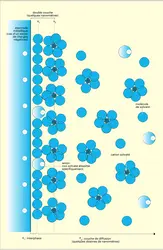
D'autre part, l'électrochimie dite ionique a pour but essentiel l'étude des solutions électrolytiques. Les réactions sont souvent négligées et on ne prend en compte que les états d'équilibre. Cette discipline, appelée également thermodynamique des solutions électrolytiques, tente donc de décrire plus parfaitement l'état d'équilibre électrostatique de particules dissociées, donc chargées, associées le plus souvent à un réseau hôte rigide (électrolytes solides) ou mobile (cas des solutions de sels minéraux dans l'eau).
Le fait d'associer sous le même vocable « électrochimie » l'étude des réactions de transfert de charge à des interfaces conductrices et celle des équilibres des ions en solution peut paraître curieux. Cela découle d'une tradition vieille de plus d'un siècle, puisque la dissociation des électrolytes en ions semblait devoir découler du passage du courant électrique. De fait, la notion d'électrochimie repose sur la connexion d'au moins deux phases conductrices, l'une électronique (électrode), l'autre ionique (électrolyte liquide le plus souvent).
Les développements
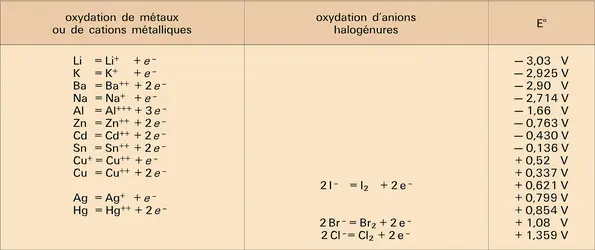
L'électrochimie semble avoir, en raison de sa nature pluridisciplinaire, une histoire complexe. Citons d'abord l'expérience célèbre de la grenouille disséquée par Luigi Galvani en 1791 : le nerf mis en contact avec un influx électrique produisit de fortes contractions du muscle, c'est l'électricité « animale ». Le début du xviiie siècle est marqué par la première pile électrique d'Alessandro Volta, puis par l'établissement des lois de rendement électrique par Michael Faraday : une quantité d'électricité de 96 500[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques SIMONET : directeur de recherche au C.N.R.S.
Classification
Pour citer cet article
Jacques SIMONET. ÉLECTROCHIMIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD, Jérôme RANDON
- 8 885 mots
- 4 médias
Les méthodes électrochimiques sont basées sur des réactions d'oxydoréduction. Elles mettent en jeu des échanges d'électrons. Un oxydant est une molécule ou un ion capable de capter un ou plusieurs électrons. En revanche, un réducteur est une molécule ou un ion qui peut donner un... -
AUTOMOBILE - Défis
- Écrit par Daniel BALLERINI, François de CHARENTENAY, André DOUAUD, Francis GODARD, Gérard MAEDER, Jean-Jacques PAYAN
- 11 590 mots
- 8 médias
Qu'est ce qu'une pile à combustible ? C'estun dispositif électrochimique qui utilise directement l'énergie dégagée par une réaction chimique pour la transformer en énergie électrique. Par exemple, la recombinaison de l'hydrogène avec l'oxygène de l'air se fait sur des électrodes en produisant un... -
BECQUEREL ANTOINE CÉSAR (1788-1878)
- Écrit par Georges KAYAS
- 344 mots
Ancien élève de l'École polytechnique (où il entre en 1806), sorti dans le corps des ingénieurs militaires, Becquerel, après la chute de Napoléon, se consacre uniquement à la science et il est le premier à occuper la chaire de physique au Muséum d'histoire naturelle de Paris (1838). Il est le chef...
-
BERZELIUS JÖNS JACOB (1779-1848)
- Écrit par Jacques GUILLERME
- 2 014 mots
- 1 média
Lafascination qu'exerçaient, à la fin du xviiie siècle, les phénomènes électriques est à l'origine de plusieurs tentatives d'interprétation de l'affinité chimique. Ritter avait remarqué que la sériation des métaux par Volta, dans l'ordre des tensions de contact, coïncide avec la série des affinités... - Afficher les 21 références
Voir aussi
- GÉNÉRATEURS D'ÉNERGIE ÉLECTRIQUE
- DISSOCIATION IONIQUE
- OSTWALD LOI DE DILUTION D'
- IONS
- ÉLECTROSTATIQUE
- CONSTANTE DE DISSOCIATION
- COURANT ÉLECTRIQUE
- FARADAY LOIS DE
- HYDROMÉTALLURGIE
- EAU, physico-chimie
- AMPÉROMÉTRIE
- ÉLECTRODES
- NERNST ÉQUATION DE
- IONISÉS MILIEUX
- ANIONS
- CATIONS
- SOLVATATION
- HYDRATATION
- CATHODE
- ANODE
- COULOMÉTRIE
- THERMODYNAMIQUE CHIMIQUE
- OXYDANTS
- RÉDUCTEUR, chimie
- POTENTIEL CHIMIQUE
- CONCENTRATION, chimie
- PILES & ACCUMULATEURS
- FARADAY, unité
- FORCE ÉLECTROMOTRICE
- DENSITÉ DE COURANT
- VOLTAMÉTRIE
- ÉLECTROLYSE
- CHIMIE HISTOIRE DE LA
- COURBE INTENSITÉ-POTENTIEL
- REDOX COUPLE
- DONNEUR, chimie
- ACCEPTEUR, chimie
- TRANSFERT D'ÉLECTRONS
- SCIENCES HISTOIRE DES