AMMONIAC
Utilisations
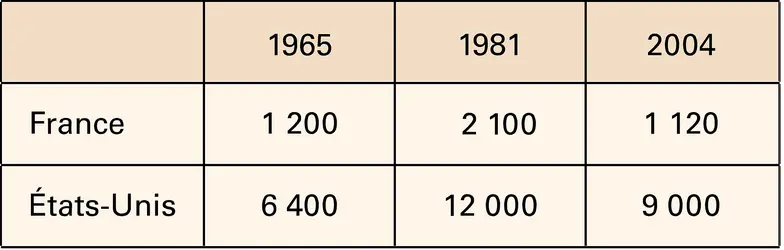
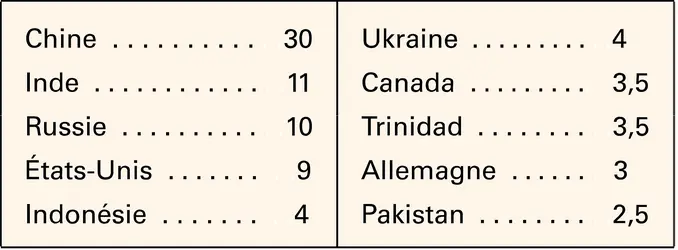
De 80 à 90 p. 100 de l'ammoniac produit sont utilisés comme engrais, soit directement sous forme de sels d'ammonium, sulfate, phosphate, soit après transformation à l'état de sels de l'acide nitrique ( nitrate d'ammonium, nitrate de potassium) ou d' urée.
On a mis au point aux États-Unis l'utilisation non seulement d'engrais liquides constitués par des solutions aqueuses de composés « azotés » : nitrate d'ammonium, urée additionnée ou non d'ammoniac (par exemple 60 p. 100 d'urée et 26 p. 100 d'ammoniac), mais aussi d'ammoniac liquide ; il est alors enfoui à 10 cm dans le sol où il se volatilise et se fixe sur l'humus ; c'est la nitrojection. Ce procédé a été expérimenté dans certaines régions de France, mais il ne semble pas devoir s'étendre ; par contre, l'utilisation d'engrais liquides préparés dans des centres agricoles est d'un emploi courant.
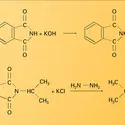
L'ammoniac est utilisé aussi comme agent de nettoiement, pour la fabrication des pâtes à papier, et en métallurgie pour réaliser les traitements thermiques. Il constitue également la matière première des synthèses de l'acide nitrique et du nitrate d'ammonium (explosif), de l'acide cyanhydrique et de l'urée (obtention de matières plastiques : aminoplastes), de l'acrylonitrile, des amines, et du perchlorate d'ammonium (propergol pour fusées). Il intervient, en étant recyclé, dans le procédé Solvay de fabrication du carbonate de sodium.
En thérapeutique, l'ammoniac est employé en solutions diluées, soit en usage externe (liniments, composés rubéfiants ou révulsifs, solutions contre les piqûres d'insectes), soit en inhalations, comme excitant de la respiration et de la circulation (dans les syncopes). Il est utilisé par les cigarettiers comme composé addictif du tabac car il facilite et augmente l’absorption de nicotine.
Chez l'homme, après dégradation des protéines, l'ammoniac est fixé par les acides glutamiques et aspartiques. On le retrouve dans l'urine sous forme d'ions ammonium (NH4+) et surtout sous forme d'urée.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Pour citer cet article
Henri GUÉRIN. AMMONIAC [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
La structure de l'ammoniac liquide, qui bout à — 33 0C, rappelle beaucoup celle de l'eau, en raison de l'existence de liaisons hydrogène. Il s'ionise suivant :Ke = [NH4+][NH2—]est de l'ordre de 3 × 10—33. La limite inférieure de l'échelle d'acidité est par...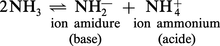
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
L'ammoniac s'additionne sur les aldéhydes, en formant un hémiaminal instable, qui se déshydrate en donnant une aldimine, généralement trimère. Le méthanal réagit d'une manière particulière avec l'ammoniac : la formaldimine, initialement formée, se condense avec deux molécules de méthanal en un composé... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
L' alkylation de l'ammoniac par les halogénures d'alkyle en solution aqueuse ou alcoolique est la méthode proposée en 1850 par A. W. von Hofmann pour leur préparation. Cette réaction conduit à un mélange de dérivés primaires, secondaires et tertiaires, ainsi qu'à l'halogénure d'ammonium quaternaire.... -
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
- Afficher les 23 références
Voir aussi
- SELS
- NITRATATION
- NEUTRALISATION, chimie
- HYDROLYSE
- HYDROGÈNE LIAISON
- AMPHOTÈRE CORPS
- BASE, chimie
- CONSTANTE DE DISSOCIATION
- EAU, physico-chimie
- CATALYSEURS
- HYDRURES
- CHIMIQUES INDUSTRIES
- AMMONIACATES
- GAZ DE FOURS
- OXYDATION
- RÉACTEUR CHIMIQUE
- URÉE
- RÉDUCTEUR, chimie
- COMPRESSEURS
- SCHWEITZER LIQUEUR DE
- NITROJECTION
- CARBOCHIMIE & PÉTROCHIMIE
- EXOTHERMIQUE RÉACTION
- AMMONIAQUE
- AMIDURES
- AMMINES
- ÉCHANGEUR DE CHALEUR
- GAZEUX ÉTAT
- DÉSULFURATION
- AZOTE ATMOSPHÉRIQUE
- CYANHYDRIQUE ACIDE
- NITRATES
- CHIMIE HISTOIRE DE LA
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- GAZ DE SYNTHÈSE