NITRIQUE ACIDE
Propriétés physiques et structurales de l'acide nitrique
L'acide pur est un liquide incolore bouillant à 84,1 0C et se solidifiant à — 41,59 0C.
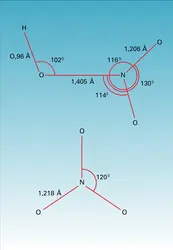
En phase vapeur, l'acide nitrique est monomère. Les molécules individuelles présentent une structure que l'on considère comme plane, bien qu'une rotation du groupement OH autour de la liaison NO contiguë ait été envisagée par certains auteurs. Une barrière de potentiel de 29,3 kJ mol—1 rend cette rotation assez peu vraisemblable et, en tout cas, la met en contradiction avec l'existence de deux angles (O - N - OH) inégaux (1160 et 1140). La figure 2 rend compte des angles et des longueurs de liaison. L'édifice HNO3 y est rapproché de l'ion nitrate NO3—, plan également, mais dont la symétrie parfaite correspond au groupe ponctuel D3h. Ces édifices plans correspondent à l'échange par l'azote de 3 liaisons σ impliquant une hybridation sp2, tandis que les orbitales pz de l'azote et des trois atomes d'oxygène mènent à des interactions de type π.
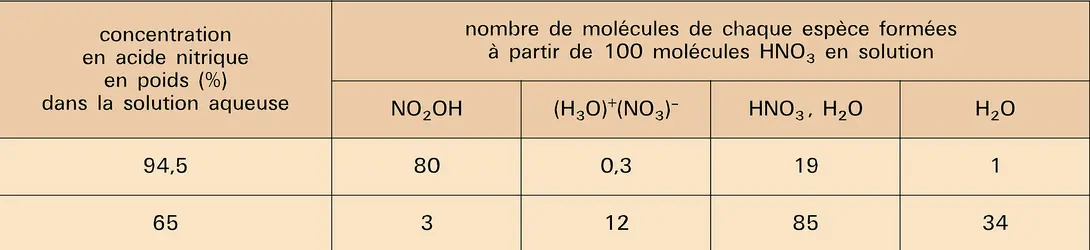
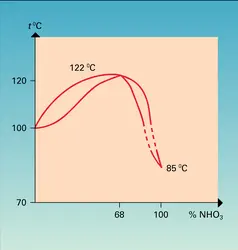
L'acide nitrique pur obtenu à l'état liquide par fusion des cristaux ne correspond pas à la présence de molécules individuelles HNO3. La molécule d'acide nitrique, aussi bien que celle de l'eau, est un accepteur et un donneur de proton. Une ionisation intervient selon la réaction 1, le cation se dissociant ensuite selon la réaction 2. À — 40 0C, le pourcentage de dissociation atteint déjà 3,5 p. 100 des molécules HNO3. La dilution de l'acide pur dans de l'eau limite cet effet, déplace le dernier équilibre vers la gauche et provoque la réaction 3, de sorte que le bilan global s'identifie à l'équilibre classique d'un acide en solution dans l'eau (réaction 4).
Le tableau illustre bien l'évolution des espèces présentes en fonction de la dilution.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean ROUXEL : professeur à l'université de Nantes
Classification
Pour citer cet article
Jean ROUXEL. NITRIQUE ACIDE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 033 mots
- 5 médias
En présence d'une toile de platine portée à 700-800 0C l'azote passe au degré + 2 en formant du monoxyde d'azote (oxyde azotique). C'est la réaction de base de la synthèse de l'acide nitrique :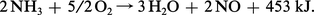
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 553 mots
- 5 médias
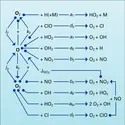
La concentration de NO et de NO2 dans la stratosphère résultant d'une production continuelle à partir de N2O (équation 13a) est cependant limitée par d'autres réactions. Nous retiendrons surtout celle qui donne lieu à la formation de l'acide nitrique par le mécanisme :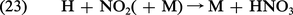
-
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
– L'acide nitrique, HNO3, résulte de l'oxydation naturelle des oxydes d'azote. Il est produit industriellement, car les nitrates servent à fabriquer des engrais et des explosifs. -
EAU RÉGALE
- Écrit par Dina SURDIN
- 223 mots
Mélange de deux ou trois volumes d'acide chlorhydrique concentré et d'un volume d'acide nitrique concentré. Les alchimistes ont appelé ce mélange « eau régale » (c'est-à-dire royale) pour ses propriétés : il dissout en effet l'or et d'autres métaux dits nobles....
- Afficher les 8 références
Voir aussi