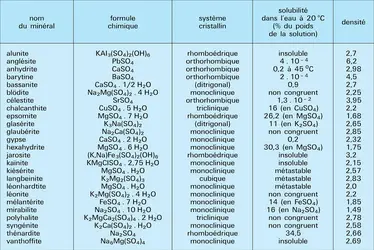
SULFATES NATURELS
Sulfates des séries salines sédimentaires
De nombreux sulfates sont des constituants habituels de séries continentales ou marines particulières, correspondant à des bassins endoréiques ou à des mers épicontinentales des zones climatiques arides. Dans les séquences d'« évaporites », les sulfates occupent des niveaux définis par leur solubilité respective : ceux de calcium précipitent après la séquence carbonatée, ceux de sodium et de magnésium n'apparaissent qu'au sommet ou à la suite des dépôts de sel gemme.
Sulfates de calcium
Les principales espèces minérales appartenant au système CaSO4-H2O sont : le gypse CaSO4.2 H2O, monoclinique (groupe A2/a), de densité 2,317, et dont la structure est formée de feuillets dont la liaison est réalisée par l'eau, ce qui autorise un clivage facile ; l'hémihydrate, ou bassanite CaSO4.1/2H2O, constituant principal du plâtre ; l'anhydrite CaSO4, orthorhombique (Bbmm), de densité 2,98.
Lorsqu'on chauffe du gypse à sec, la déshydratation commence vers 40 0C. Un palier, correspondant à l'hémihydrate, est atteint dès 70 0C. Vers 95 0C, la majeure partie de l'eau restante se dégage. Le corps obtenu, presque anhydre, a encore la structure du plâtre et possède la propriété de se réhydrater instantanément en présence d'eau, ce qui en fait un déshydratant puissant utilisé dans le commerce sous le nom d'anhydrite soluble ou réversible. Il faut chauffer à 450 0C pendant plus d'une heure pour obtenir l'anhydrite orthorhombique, stable.
L'hémihydrate lui-même se réhydrate facilement en présence d'eau en fournissant des aiguilles de gypse dont l'imbrication assure une solidité remarquable aux enduits de « plâtre » utilisés en application sur les murs intérieurs des habitations.
La connaissance de la température de transition gypse-anhydrite en solution est du plus haut intérêt en géologie. Malheureusement, si étrange que cela puisse paraître, cette température est très mal connue, malgré une somme considérable d'expériences. La thermodynamique chimique ne fournit qu'une valeur calculée très grossière de 46 ± 25 0C, et les expériences les plus récentes (L. A. Hardie) situent celle-ci au voisinage de 55 à 60 0C dans l'eau pure. La présence de certains ions modifie sensiblement le point de transition. C'est ainsi que la saturation en NaCl abaisse ce point de 25 0C, mais d'autres ions inhibent l'apparition de l'anhydrite par formation sur les germes de celle-ci de couches monomoléculaires de sels solubles ; ce phénomène favorise la genèse de gypse métastable (effet Conley-Bundy, 1958). Il apparaît alors que l'anhydrite primaire ne peut se former en abondance que dans des conditions très improbables de nos jours.
Sur l'équilibre gypse ⇌ anhydrite + eau, la pression joue un rôle qui dépend des possibilités d'évacuation de l'eau, car le volume anhydrite + eau est plus fort que le volume du gypse initial. La température de transition n'est abaissée par la pression que si l'eau libérée peut percoler facilement vers le haut ; cet abaissement est, dans ce cas, voisin de 1 0C pour un enfoncement de 200 mètres. En général, l'anhydrite résulte de l'enfouissement du gypse qui se trouve soumis à des pressions et à des températures croissantes. Lorsque les conditions nécessaires sont atteintes, la déshydratation peut être très rapide.
En revanche, sous l'action des mouvements orogéniques et de l'érosion, l'anhydrite se réhydrate lentement lors de son retour vers la surface. Les deux phénomènes d'enfouissement-déshydratation et de soulèvement-hydratation permettent de définir un cycle de sulfate de calcium dans l'écorce terrestre.
La plasticité du gypse et sa déshydratation facile lui font jouer[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JAUZEIN : professeur à la faculté des sciences de l'université de Paris-VI-Pierre-et-Marie-Curie, directeur du laboratoire de géologie de l'École normale supérieure de Paris
Classification
Pour citer cet article
André JAUZEIN. SULFATES NATURELS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ANHYDRITE
- Écrit par Yves GAUTIER
- 253 mots
Sulfate anhydre de calcium, l'anhydrite, fréquemment incolore ou blanche à grise, parfois bleutée à rosâtre, se présente généralement en masse finement cristallisée ou granulaire. Les cristaux bien exprimés (prismatiques courts et tabulaires) sont rares. On la reconnaît facilement grâce à ses trois...
-
BARYTINE
- Écrit par Yannick LOZAC'H
- 306 mots
Sulfate de baryum (BaSO4) cristallisé dans le système orthorhombique. Les cristaux s'assemblent fréquemment en masses lamellaires, par suite du développement de la face (001) ; les cristaux prismatiques sont beaucoup plus rares. Le plus souvent, ce sont des amas granulaires, cryptocristallins....
-
BARYUM
- Écrit par Bernard CARTON
- 330 mots
Du grec barus, lourd
Symbole chimique : Ba
Numéro atomique : 56
Masse atomique : 137,34 g
Point de fusion : 725 0C
Point d'ébullition : 1 640 0C
Densité (à 20 0C) : 3,5.
Deuxième membre de la famille des alcalinoterreux (après le calcium), dont C. W. Scheele découvrit la base (baryte)...
-
CALCIUM
- Écrit par Jean PERROTEY
- 2 292 mots
- 2 médias
Le sulfate est lui aussi important, puisque, sous sa forme hydratée, il constitue le plâtre. Le gypse naturel est bihydraté ; chauffé à une température inférieure à 150 0C, il perd 1,5 molécule d'eau et, au-delà, le sulfate anhydre β se forme ; ces phases de la déshydratation étant réversibles,... - Afficher les 16 références
Voir aussi