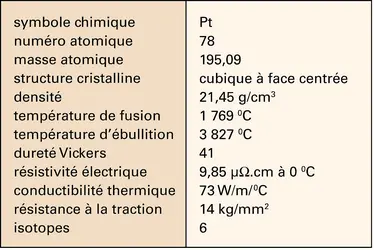
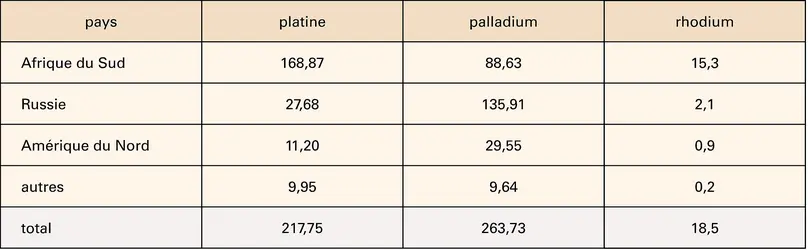
PLATINE ET PLATINOÏDES
Applications
La plupart des industries qui utilisent les métaux précieux, notamment les platinoïdes, les récupèrent après utilisation : ces métaux, après affinage, sont recyclés. Ce ne sont donc pas des matériaux consommables et seule leur acquisition constitue un investissement. C'est uniquement au niveau des nouveaux développements ou des accroissements de production qu'il est nécessaire de s'approvisionner en nouveaux métaux.
C'est l'industrie automobile qui consomme aujourd'hui le plus de platine (fig. 4). Elle n'en utilisait pas en 1970, alors qu'en 1980 elle en consommait près de 15 tonnes par an, et près de 60 tonnes à la fin du xxe siècle et près de 110 tonnes en 2008. Cette consommation est, pour l'essentiel, apparue avec la mise en vigueur progressive des catalyseurs de postcombustion automobile en fonction de nouvelles normes antipollution adoptées par les États-Unis à partir de 1979 et par l'Europe en mars 1985. Le platine est utilisé pour diminuer la pollution créée par les gaz d'échappement des moteurs à essence (oxyde de carbone, hydrocarbures et oxydes d'azote).
La consommation européenne de platine et palladium croît d'autant plus avec les nouvelles normes européennes de limitation des émissions d'oxydes de carbone, d'azote, d'hydrocarbures imbrûlés et de particules solides qui imposent la présence de catalyseurs de postcombustion au sein de l'échappement des véhicules diesel. Pour l'industrie automobile, près des deux tiers de la consommation de platine proviennent ainsi de la fabrication des pots catalytiques qui a augmenté de 135 p. 100 en dix ans pour culminer à environ 132 tonnes en 2007.
Signalons aussi que la plupart des véhicules utilisent des bougies d’allumage munies d’électrodes en platine.
Les piles à combustibles sont un dispositif qui génère du courant électrique. Elles sont développées dans le but de servir d'alternative aux moteurs à explosion des véhicules automobiles (cf. automobile). La plupart d'entre elles utilisent la technologie PEMFC (Proton Exchange Membrane Fuel Cell), avec une membrane transformant l'hydrogène H2, en proton H+ pour produire de l'énergie à partir de l'hydrogène et de l'oxygène, en utilisant l'effet catalyseur du platine. L'utilisation de piles à combustibles présente des avantages aussi bien environnementaux, qu'économiques. Elles sont plus efficaces en termes de rendement énergétique et moins polluantes. La recherche actuelle est concentrée sur l'amélioration de la performance et la réduction des coûts des piles à combustibles. Elles peuvent également être un vecteur de génération d'énergie électrique en vue d'autres applications. L'utilisation du platine dans les piles à combustibles semble être l'une de ses applications présentant les meilleures perspectives de demande dans le futur.
La demande dans le secteur de la joaillerie international comptait pour 25 p. 100 de la demande totale en platine en 2006 (contre 50 p. 100 en 2000). Ce métal précieux est très apprécié des joailliers du fait de sa beauté, de sa pureté et de ses propriétés particulières. En Europe et aux États-Unis, le degré de pureté courante est de 95 p. 100, tel qu'indiqué sur les différents articles de joaillerie par le poinçon Pt 950. Ce degré de pureté contraste avec celui des autres métaux tels que l'or, qui se situe habituellement entre 33 et 75 p. 100. Dans certains autres États, celui-ci peut descendre jusqu'à moins de 85 p. 100. La couleur du platine, sa solidité, sa dureté et sa résistance au ternissement sont parmi les nombreux avantages que compte ce produit. Il fournit un support solide aux diamants et autres pierres précieuses, rehaussant leur brillance. De plus, sa malléabilité est un élément important pour les créateurs de [...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Paul GUERLET : ingénieur E.N.S.C.P., docteur ès sciences physiques, directeur des recherches au comptoir Lyon-Alemand-Louyot
- Roger LACROIX : ingénieur chimiste, chef du laboratoire de recherches au comptoir Lyon-Alemand-Louyot
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
- Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Pour citer cet article
Universalis, Jean-Paul GUERLET, Roger LACROIX et Jean-Louis VIGNES. PLATINE ET PLATINOÏDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ÉLÉMENTS NATIFS
- Écrit par Guy ROGER
- 2 071 mots
- 3 médias
Le platine existe presque toujours à l'état natif, mais non pur, car il forme des alliages, essentiellement avec d'autres métaux de la famille du platine (surtout l'iridium) et avec le fer. -
NEWJANSKITE & SYSSERTSKITE
- Écrit par Guy TAMAIN
- 209 mots
Minéraux du groupe de l'iridosmine composés principalement d'osmium et d'iridium en solution solide, la newjanskite et la syssertskite (découvertes dans l'Oural, à Neviansk et à Syssert respectivement) cristallisent dans le système hexagonal et se présentent sous forme de lamelles ou grains tabulaires....
-
POLYXÈNE
- Écrit par Philippe ROSSI
- 426 mots
Solution solide formée de nombreux complexes isomorphes, qui contient en moyenne 83 p. 100 de platine, 10 p. 100 de fer, jusqu'à 7 p. 100 d'iridium, et des traces de palladium, de rhodium, de cuivre et de nickel ; on nomme souvent platine natif ce système minéral.
Le polyxène cristallise...
-
SAINTE-CLAIRE DEVILLE HENRI (1818-1881)
- Écrit par Georges KAYAS
- 272 mots
Chimiste français né à l'île Saint-Thomas (Antilles) et mort à Boulogne-sur-Seine. Fils d'un consul de France, Henri Étienne Sainte-Claire Deville obtient, en 1844, deux doctorats, en médecine et en sciences ; il est alors chargé de l'organisation de la nouvelle faculté des sciences de Besançon...
Voir aussi
- RHODIUM
- RUTHÉNIUM
- CATALYSE HOMOGÈNE
- CATALYSE HÉTÉROGÈNE
- MATIÈRES PREMIÈRES
- RECYCLAGE DES DÉCHETS ET DES MATÉRIAUX
- MÉTAUX PRÉCIEUX, histoire
- PLATINOÏDES ou MÉTAUX DE LA MINE DU PLATINE
- GISEMENTS MÉTALLIFÈRES
- ÉNERGIE SOURCES D'
- PILE À COMBUSTIBLE
- CATALYSEURS
- CHIMIQUES INDUSTRIES
- JOAILLERIE
- PLATINE
- PALLADIUM
- TRANSITION MÉTAUX DE
- AUTOMOBILE INDUSTRIE
- GAZ D'ÉCHAPPEMENT
- FIBRES DE VERRE
- RESSOURCES MINIÈRES
- BIOMATÉRIAUX
- POT CATALYTIQUE
- CIS-PLATINE
- PÉTROLIÈRE INDUSTRIE
- OSMIUM
- IRIDIUM