MENDELEÏEV DMITRI IVANOVITCH (1834-1907)
La classification périodique des éléments
L'établissement de la classification périodique exigeait la connaissance des propriétés chimiques des éléments et celle de leur poids atomique, puisque cette classification traduit la relation existant entre ces notions apparemment distinctes. Si les propriétés d'un bon nombre d'éléments étaient relativement bien connues, il n'en était pas de même des poids atomiques.
Les importants travaux d'analyse chimique du Suédois Jöns Jacob Berzelius et du Belge Jean-Servais Stas, notamment, avaient conduit à une connaissance assez complète et précise des poids équivalents des éléments, c'est-à-dire des proportions relatives selon lesquelles ils se combinent entre eux pour former un composé défini. Mais, pour définir le poids atomique, il fallait en outre connaître le nombre d'atomes de chaque élément dans ces composés, c'est-à-dire sa valence (ce terme se définit, par exemple, comme le nombre d'atomes d'hydrogène pouvant être fixés par un élément). L'hypothèse d'Avogadro, suivant laquelle une molécule d'un composé occupe à l'état gazeux le même volume que deux équivalents d'hydrogène, avait permis dans bien des cas de fixer le poids moléculaire du composé et, par conséquent, le poids atomique des constituants et leur valence. Dans d'autres cas, ce but était atteint en utilisant d'autres propriétés, comme l'isomorphisme des cristaux (même structure cristalline) ou la loi de Dulong et Petit liant les chaleurs spécifiques aux poids atomiques. Une ambiguïté subsistait cependant pour certains éléments assez mal connus, et la liste des poids atomiques et des valences dont disposait Mendeleïev comportait de nombreuses erreurs.
Plusieurs chimistes avaient déjà pressenti l'existence d'une relation entre les poids atomiques et les propriétés chimiques des éléments. En 1839, Johann Döbereiner montre l'existence de triades d'éléments de propriétés voisines et tels que le poids équivalent de l'un est égal à la demi-somme de ceux des deux autres (comme le chlore, le brome et l'iode). D'autres chimistes (Max von Pettenkofer, Jean-Baptiste Dumas, John Gladstone, Josiah Cooke, William Odling) le suivront dans cette voie, mais la première classification par ordre croissant de poids atomique n'apparaît qu'en 1863, avec la « vis tellurique » d'Alexandre Beguyer de Chancourtois, une hélice s'enroulant autour d'un cylindre et le long de laquelle sont disposés les éléments. Ceux dont le poids atomique diffère de seize unités sont placés sur une même génératrice verticale du cylindre, et de Chancourtois souligne les analogies de propriétés au sein des familles ainsi constituées.
Une autre classification des éléments suivant les poids atomiques croissants est proposée en 1865 par John Newlands, qui leur attribue un numéro d'ordre et remarque que l'on retrouve des éléments de propriétés semblables chaque fois que ce numéro s'accroît de sept unités. Il définit ainsi la loi des octaves. Mais ce classement n'est pas pris au sérieux par ses contemporains et la Société chimique de Londres refuse de publier ses articles.
Enfin, Ludwig Meyer, en 1864, classe vingt-huit éléments en cinq colonnes, selon leur valence. Il montre que les poids atomiques s'accroissent dans chaque colonne selon une loi particulière. En 1868, il prépare un tableau beaucoup plus complet, en seize colonnes, ressemblant beaucoup à celui de Mendeleïev. Il ne le publie qu'en 1870, c'est-à-dire après la parution de celui de Mendeleïev, et sans en revendiquer la priorité.
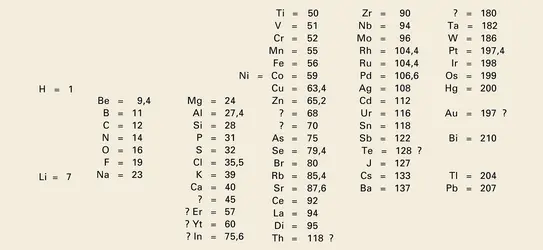
En 1869, Mendeleïev ignore tout de ces travaux et n'a eu connaissance que des essais, assez anciens, de Dumas et Pettenkofer. Pour faciliter sa classification, il a noté le nom de chaque élément[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- René BIMBOT : agrégé de sciences physiques, docteur ès sciences, maître de recherche au C.N.R.S.
Classification
Pour citer cet article
René BIMBOT. MENDELEÏEV DMITRI IVANOVITCH (1834-1907) [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ATOMIQUE PHYSIQUE
- Écrit par Philippe BOUYER, Georges LÉVI
- 6 651 mots
- 1 média
...la nature, et même de prévoir des atomes qui n'y existent pas. Elle a justifié a posteriori le tableau périodique des éléments établi en 1869 par Dmitri Mendeleïev. En effet, la capacité d'un atome à se lier à un autre pour former une molécule dépend essentiellement des électrons des couches... -
TABLEAU PÉRIODIQUE DES ÉLÉMENTS
- Écrit par Séverine BLÉNEAU-SERDEL
- 1 956 mots
- 3 médias
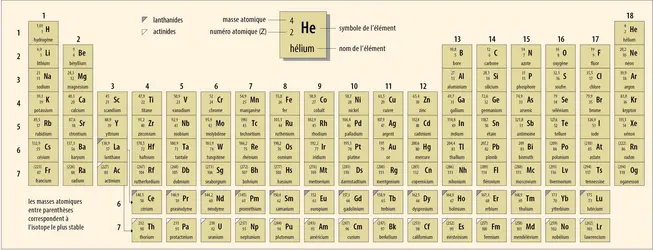
La classification périodique des éléments organise tous les éléments chimiques dans un tableau composé de dix-huit colonnes (ou groupes) et de sept lignes (ou périodes). Ils sont classés d’une part par numéro atomique (Z) croissant : un nombre entier, compris entre 1 et 118, qui indique le nombre de...
Voir aussi