CORROSION
- Article mis en ligne le
- Modifié le
- Écrit par Gérard BERANGER et Jean TALBOT
La corrosion sèche
La corrosion sèche correspond à l'attaque d'un métal M par un gaz G pour donner le composé C :

Tous les métaux et alliages, à l'exception des métaux nobles (l'or, par exemple), sont attaqués par les gaz à température suffisamment élevée. Parmi toutes les réactions possibles, ce sont surtout celles avec l' oxygène qui ont été le plus étudiées : au sens traditionnel du terme c'est l' oxydation. Mais, en fait, on peut donner à ce dernier terme son sens le plus large et qui caractérise alors l'action d'un élément électronégatif sur un métal ou un alliage : soufre, halogènes (Cl, Br, I), azote, etc. Ces différents éléments actifs peuvent être sous forme libre ou sous forme combinée : vapeur d'eau, monoxyde et dioxyde de carbone, anhydride sulfureux et hydrogène sulfuré, ammoniac, etc.
L'action de ces différents éléments obéit généralement aux mêmes principes et lois et s'étudie expérimentalement selon les mêmes méthodes. Il est alors possible de décrire plus particulièrement les réactions avec l'oxygène, étant bien entendu que les résultats peuvent être étendus à d'autres éléments électronégatifs.
On ne peut se limiter, pour comprendre les processus de l'oxydation, à appliquer seulement les lois de la thermodynamique. En effet, lorsqu'un oxyde se forme à la surface d'un métal, il isole de plus en plus celui-ci de l'oxygène ; aussi, la vitesse de croissance de la couche d'oxyde n'est pas contrôlée par la réaction chimique (1) mais par la diffusion soit du métal, soit de l'oxygène à travers le film solide : c'est un processus physique.
Au cours de l'oxydation d'un métal, il est important de considérer le rapport Δ du volume équivalent de l'oxyde formé à celui du métal attaqué (coefficient d'expansion) :
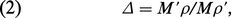
En fait, les processus de l'oxydation sont relativement complexes, et leur interprétation nécessite de faire appel à différentes disciplines scientifiques. Les aspects structuraux et mécaniques, en particulier, revêtent une importance parfois prédominante.
Pour un métal donné, la vitesse d'attaque dépend de la température. Mais, en dehors de ce facteur important, d'autres paramètres interviennent directement sur le déroulement de la réaction : la pression partielle et la composition du gaz, la pureté du métal ainsi que sa structure et son état de surface.
Structure et défauts des oxydes. Diffusion
Pour que la réaction puisse se poursuivre, il est nécessaire que le métal et l'oxygène puissent venir au contact l'un de l'autre, c'est-à-dire qu'ils puissent diffuser à travers l'oxyde. Donc, suivant les cas, la réaction d'oxydation se produira : à l' interface métal-oxyde s'il s'agit d'une diffusion préférentielle d'oxygène (c'est le cas de Ti/TiO2, Zr/ZrO2 et U/UO2), à l'interface oxyde-oxygène s'il s'agit d'une diffusion préférentielle des ions métalliques (Fe/FeO et Ni/NiO).
Les oxydes sont des édifices cristallins dans lesquels l'oxygène et le métal sous forme ionique occupent des sites bien déterminés. Mais ces cristaux présentent des défauts ponctuels de deux types principaux : un cation interstitiel et une lacune de cation (défauts de Frenkel), comme pour AgBr ; une lacune d'anion et une lacune de cation (défauts de Schottky),[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Gérard BERANGER : Professeur, directeur du laboratoire des matériaux de l'université de technologie de Compiègne
- Jean TALBOT : professeur à l'université de Paris-VI-Pierre-et-Marie-Curie et à l'École nationale supérieure de chimie de Paris
Classification
Pour citer cet article
Gérard BERANGER et Jean TALBOT. CORROSION [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 176 mots
- 10 médias
Malgré leur résistance dans de nombreux milieux « agressifs », les aciers inoxydables peuvent être sensibles à certaines formes de corrosion, qu'il est important de connaître. -
AUTOMOBILE - Technologie
- Écrit par Georges BRESSON , Jean-Pierre CAPET , François de CHARENTENAY , Encyclopædia Universalis , Thierry HALCONRUY , Frédéric RIVAS et Jean-Pierre VÉROLLET
- 15 879 mots
- 27 médias
Laprotection anticorrosion assure une tenue sans perforations de l'ordre de dix ans grâce à des tôles préprotégées par zingage ou peintures performantes, à une couche d'apprêt par trempé en électrophorèse (technique utilisant aujourd'hui l'eau comme solvant, ce qui permet de réduire la... -
BÉTON
- Écrit par Jean-Michel TORRENTI
- 8 163 mots
- 1 média
– XC1 à XC4 : corrosion induite par carbonatation, le risque croissant de 1 à 4 ; -
CHLORURE D'HYDROGÈNE
- Écrit par Encyclopædia Universalis
- 574 mots
Formule brute : HCl
Masse moléculaire : 36,46 g
Point d'ébullition : — 84,9 0C
Point de fusion : — 114 0C
Température critique : 51,54 0C.
Gaz incolore d'odeur forte et étouffante, très soluble dans l'eau (qui à la température ordinaire en dissout environ 450 fois son volume),...
- Afficher les 16 références






