CARBONATES
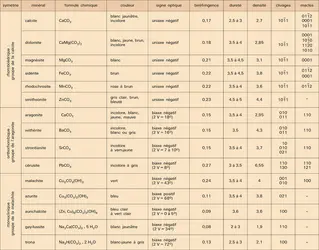
Les carbonates sont des minéraux largement représentés à la surface du globe. Le carbonate de calcium, en particulier, est le constituant principal des coquilles de nombreux organismes. On le retrouve surtout dans la lithosphère sous forme de roches dites calcaires, les plus abondantes parmi les roches sédimentaires. Ce stock considérable de carbone est alimenté par le métabolisme des êtres vivants sous forme de gaz carbonique, lequel donne notamment, en se combinant avec les métaux divalents, des composés insolubles dans les conditions normales de la lithosphère : les carbonates. Des dissociations ultérieures peuvent cependant intervenir, à la faveur desquelles le carbone mis en réserve est restitué à la biosphère et à l'atmosphère. Ainsi les carbonates se trouvent à la croisée des cycles biochimique et géochimique du carbone, localisés essentiellement dans la zone superficielle de la lithosphère. La présence des carbonates dans les roches d'origine interne est, en effet, exceptionnelle et elle pose l'un des problèmes les plus intéressants de la pétrologie, celui de l'origine « primaire » du carbone en profondeur.
Le caractère structural essentiel des carbonates est la présence de l'ion CO23—. Tout atome de carbone s'y trouve au centre d'un triangle équilatéral dont chacun des sommets est occupé par un atome d'oxygène. Aucun ion oxygène n'est commun à deux groupements triangulaires carbone-oxygènes ; ceux-ci doivent être considérés comme des unités distinctes dans la structure des minéraux carbonatés et ils sont largement responsables des propriétés particulières de ce groupe. La liaison entre le carbone central et les oxygènes qui lui sont coordinés n'est pas aussi forte que celle qui existe dans CO2. En présence de l'ion hydrogène, le radical carbonate devient instable et se brise pour fournir du gaz carbonique et de l'eau. Cette instabilité est à l'origine des tests avec les acides, utilisés pour la reconnaissance des carbonates.
Lorsque l'ion carbonate est combiné avec les cations divalents (Ca, Fe...), il en résulte, pour les composés formés, des structures de géométrie simple qui sont généralement de type rhomboédrique ou orthorhombique. Le carbonate de calcium se partage entre les deux types et cristallise à la fois avec la structure rhomboédrique de la calcite et la structure orthorhombique de l'aragonite.
À côté des minéraux qui appartiennent à ces deux grands groupes et qui font l'objet de cet article, il existe des composés carbonatés de structure monoclinique, dont les plus importants (signalés dans le tableau) seront rapidement décrits à la fin de cet article.
Minéraux du groupe de la calcite
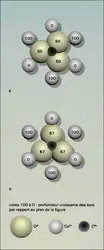
La structure de la calcite, dont les autres minéraux du groupe sont isostructuraux, a été décrite pour la première fois par Bragg en 1937 ; elle peut se déduire de celle du chlorure de sodium (halite), en imaginant des ions calcium à la place des ions sodium, des ions carbonate à la place des ions chlore, en imaginant aussi que la structure cubique est comprimée suivant l'un des axes ternaires A3 de telle façon que les faces forment entre elles des angles de 740 55′ (au lieu de 900 dans le cube). A3 devient alors l'axe unique, perpendiculaire à des plans peuplés alternativement d'ions Ca2+ et d'ions CO23— ; ceux-ci étant eux-mêmes des plans remplaçant des ions Cl—sphériques, la symétrie devient ainsi rhomboédrique. Chaque ion calcium est coordiné à 6 ions oxygène et chaque ion oxygène est coordiné à 2 ions calcium.
Calcite
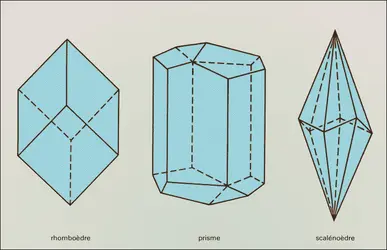
À la structure de ce minéral, qui vient d'être décrite (groupe de symétrie : 3̄ m) peuvent correspondre des formes cristallines très variées (près de 300 formes différentes ont été reconnues) et souvent très complexes. Les plus fréquentes sont celles du rhomboèdre, du prisme et du scalénoèdre[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Marc DARDENNE : docteur en géologie
- André JAUZEIN : professeur à la faculté des sciences de l'université de Paris-VI-Pierre-et-Marie-Curie, directeur du laboratoire de géologie de l'École normale supérieure de Paris
Classification
Pour citer cet article
Marc DARDENNE et André JAUZEIN. CARBONATES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
BARYUM
- Écrit par Bernard CARTON
- 330 mots
Du grec barus, lourd
Symbole chimique : Ba
Numéro atomique : 56
Masse atomique : 137,34 g
Point de fusion : 725 0C
Point d'ébullition : 1 640 0C
Densité (à 20 0C) : 3,5.
Deuxième membre de la famille des alcalinoterreux (après le calcium), dont C. W. Scheele découvrit la base (baryte)...
-
BÉRYLLIUM
- Écrit par Jean-Paul CARRON, Robert GADEAU, Jean PERROTEY
- 5 410 mots
- 5 médias
Le carbonate basique sert d'intermédiaire dans la préparation des autres sels. Les solutions de glucine, dans le carbonate d'ammonium, portées à l'ébullition après dilution, laissent déposer un produit de composition variable, amorphe aux rayons X et contenant de 2 à 5 molécules d'hydroxyde pour une de... -
CALCAIRES
- Écrit par Charles POMEROL
- 5 177 mots
- 8 médias
Une roche est dite calcaire si elle renferme au moins 50 p. 100 de carbonate de chaux (CaCO3), généralement représenté par de la calcite, plus rarement par de l'aragonite ; les minéraux les plus fréquemment associés au carbonate de chaux dans les roches calcaires sont la dolomite, CaMg(CO...
-
CALCIUM
- Écrit par Jean PERROTEY
- 2 292 mots
- 2 médias
Le calcium, élément chimique de symbole Ca et de numéro atomique 20, est le plus léger des métaux alcalinoterreux vrais. Il représente environ 3,45 p. 100 du poids de la croûte terrestre et se classe, par ordre d'abondance, au troisième rang des métaux, derrière l'aluminium et...
- Afficher les 20 références
Voir aussi
- AURICHALCITE
- ANKÉRITE
- BREUNÉRITE
- CARBONATE ION
- RHODOCHROSITE ou DIALOGITE
- STALAGMITES & STALACTITES
- SIDÉRITE ou SIDÉROSE ou FER SPATHIQUE, minéralogie
- SPHÉROSIDÉRITE
- SMITHSONITE
- WHITÉRITE
- STRONTIANITE
- CÉRUSITE
- HYDROMAGNÉSITE
- LANSFORDITE
- MEIGEN RÉACTION DE
- NESQUEHONITE
- CALCITE
- ARAGONITE
- DOLOMITE
- BASTNAÉSITE
- DOLOMIES
- NATRON
- SPATH D'ISLANDE
- MAGNÉSITE
- DOLOMITES
- SÉDIMENTAIRES ROCHES
- MINÉRAUX
- DOLOMITISATION
- RÉCIFS
- HYDROZINCITE
- CYCLE GÉOCHIMIQUE
- CARBONATE DE CALCIUM