CONSTANTE D'ÉQUILIBRE, chimie
Articles
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
À ces équilibres correspondent des constantes :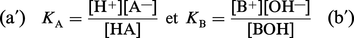
-
COMPLEXES, chimie
- Écrit par René-Antoine PARIS, Jean-Pierre SCHARFF
- 4 304 mots
- 5 médias
...ternaire s'il possède seulement deux types de coordinats différents A et B). Les études effectuées sur ces espèces ont démontré la surstabilisation des complexes mixtes par rapport aux complexes simples binaires, que l'on peut apprécier par exemple au moyen de laconstante d'équilibre de la réaction :
-
IMMUNOCHIMIE
- Écrit par Joseph ALOUF
- 9 358 mots
- 6 médias
La constante d'équilibre K, appelée aussi constante d'association intrinsèque, est, par définition, l'affinité intrinsèque de l'anticorps. Celle-ci a donc une définition thermodynamique quantitative précise. K, dénoté parfois Ka, a les dimensions d'un inverse de concentration,... -
IONS ÉCHANGEURS D'
- Écrit par Robert ROSSET
- 6 108 mots
- 13 médias
KAB est la constante d'équilibre, les quantités entre crochets représentent les activités de A et B dans la résine et dans la solution. En fait, les activités dans la résine sont difficilement accessibles, et il est plus commode d'utiliser les concentrations dans les deux phases ; K... -
NUCLÉAIRE (PHYSIQUE) - Isotopes
- Écrit par René BIMBOT, René LÉTOLLE
- 5 400 mots
- 1 média
...donc aux fréquences correspondantes. Il en résulte que, si l'on écrit l'équilibre sous la forme :où X et X* sont deux isotopes du même élément, la constante d'équilibre : où [AX*] est la concentration de la molécule AX*, n'est pas égale à 1. Elle est d'autant plus différente de 1 que l'effet...
où [AX*] est la concentration de la molécule AX*, n'est pas égale à 1. Elle est d'autant plus différente de 1 que l'effet...
-
SOLUTION ÉQUILIBRES EN
- Écrit par Claude COLIN, Alain JARDY
- 9 581 mots
- 16 médias
Par exemple, l'acide HF (pKA = 3,2) est un acide plus fort que NH4+ (pKA = 9,2) ; la réaction :



