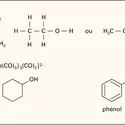
COORDINATION (chimie) Chimie de coordination
Les composés organométalliques
Les complexes dérivés des alcènes
Bien que, déjà en 1830, W. C. Zeise ait pu obtenir un composé du platine et de l'éthylène, la capacité des métaux de transition à fournir des composés organométalliques n'a été vraiment reconnue qu'au cours des années cinquante. L'anion PtCl3C2H4- en est certainement l'exemple le plus simple, à propos duquel a pu être développé un modèle de liaison (connu sous le nom de modèle de Chatt-Dewar) qui, avec ses deux composantes σ (C→M) et π (M→C), est très voisin de celui qui est retenu pour les liaisons M − CO et M − ER3 (avec E = P, As, Sb...).
La chimie des composés mono-oléfiniques et polyoléfiniques est extrêmement développée, en particulier dans ses relations avec les phénomènes catalytiques. Les ligands 1,5-cyclo-octadiène et norbornadiène mettant à profit l'effet de chélation ont été très souvent utilisés.
Les complexes dérivés des alcynes
Il existe de nombreux complexes dans lesquels un carbure acétylénique joue essentiellement le même rôle qu'un oléfine. Dans d'autres cas, l'existence de deux systèmes π dégénérés conduit l'alcyne, par duplication de la situation existant avec les oléfines, à se lier à deux atomes métalliques. C'est ce qui apparaît par exemple dans les composés Co2(CO)6(RC ≡ CR) : .
Dans certains cas enfin, tel celui du complexe L2Pt(PhC2Ph), la meilleure description du ligand acétylénique se rapproche de celle d'un dianion comme résultat d'une « addition oxydante » (cf. chap. 3) sur le platine.
La liaison σ M-C
Après des tentatives infructueuses faites pour obtenir des composés alkylés ou arylés des métaux de transition simples (en l'absence de ligands π-accepteurs stabilisants), il est apparu que l'apparente « instabilité » ainsi observée n'était pas le résultat d'une faible énergie de liaison M-C. Le plus souvent, il s'agit d'une labilité cinétique importante due à une possibilité de β-élimination (réaction inverse de l'« insertion ») d'un atome d'hydrogène (cf. chap. 3).
La liaison métal-carbone dite σ simple apparaît dans de très nombreux composés et on peut citer des cas remarquables comme Ti(CH3)4, W(CH3)6 ou (CO)5Mn(CH3). Par contre, on doit admettre l'existence de liaisons métal-carbone multiples dans des complexes où se trouvent stabilisées des formes carbéniques, ainsi dans :


Les complexes de ligands hydrocarbonés cycliques
Dans ce domaine, le ferrocène Fe(C5H5)2 est certainement remarquable à la fois par sa stabilité (il n'est pas détruit à 500 0C) et par sa structure. Dans le motif C5H5Fe, les cinq atomes de carbone de l'anion cyclopentadiényle sont également liés à l'atome métallique et forment une couronne possédant un axe de symétrie d'ordre cinq. Ce motif se retrouve dans de nombreux dérivés appelés parfois « composés sandwich », structuralement analogues au ferrocène, les métallocènes M(C5H5)2, avec M = Ni(II), Cr(II), Co(II), etc., mais aussi dans des dérivés pseudotétraédriques comme (C5H5)2TiCl2 ou (C5H5)2WH2. Par ailleurs, l'anion cyclopentadiényle n'est pas le seul qui puisse être lié symétriquement à un atome métallique ; les espèces cycliques C3R3+, C4H42-, C6H6, C7H7+ , C8H82- et leurs dérivés qui, comme C5H5- , possèdent un nombre d'électrons susceptible de leur conférer l'aromaticité, forment également des complexes remarquables dont le prototype est le chrome dibenzène Cr(C6H6)2. On pourra noter de plus que certains anions dérivés du bore, en forme de nid, tel B9C2H11- , conduisent à des composés de type voisin.
Enfin, il a été possible de construire des édifices (C5H5)3M2 dans lesquels les trois cycles cyclopentadiényle superposés emprisonnent[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- René POILBLANC : professeur à l'université Paul-Sabatier, Toulouse, directeur du laboratoire de coordination du C.N.R.S.
Classification
Pour citer cet article
René POILBLANC. COORDINATION (chimie) - Chimie de coordination [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
L'argent se distingue très nettement de ses partenaires du groupe I b.En effet, les coordinations habituelles pour le cuivre et l'or sont 2 et 4, les plus importantes étant 4 pour le cuivre et 2 pour l'or. L'argent adopte indifféremment les coordinations 2, 4 et 6, et la coordination 3 peut aussi... -
CHIMIE - La chimie aujourd'hui
- Écrit par Pierre LASZLO
- 10 856 mots
- 3 médias
Lachimie de coordination étudie les complexes, où un atome de métal s'entoure de molécules neutres ou d'ions, désignés sous le nom de coordinats (ou ligandes ou ligands), qui sont des bases de Lewis, porteuses d'au moins une paire d'électrons. Les ions métalliques ont des orbitales vacantes, ce sont... -
CHIMIE - La nomenclature chimique
- Écrit par Nicole J. MOREAU
- 5 031 mots
- 7 médias
C'est un système additif, développé à l'origine pour lescomposés de coordination, qui sont des composés formés d'un ou plusieurs atomes centraux au(x)quel(s) sont attachés d'autres atomes ou groupes d'atomes, appelés ligands. Ces ligands définissent un polyèdre de coordination... -
COMPLEXES, chimie
- Écrit par René-Antoine PARIS, Jean-Pierre SCHARFF
- 4 304 mots
- 5 médias
...supérieur, résultant de l'association de coordinats en nombre supérieur à celui fixé par la valence normale de l'ion métallique. En effet, la théorie de la coordination fut proposée en 1893 par Alfred Werner (prix Nobel de chimie en 1913) dont les travaux permirent de développer rapidement l'aspect structural... - Afficher les 10 références
Voir aussi
- CARBONYLES MÉTALLIQUES
- IONS
- COORDINENCE ou NOMBRE DE COORDINATION
- COORDINATION LIAISON DE
- CATALYSE HOMOGÈNE
- IONS MÉTALLIQUES
- COMPLEXES POLYNUCLÉAIRES
- CYCLIQUES COMPOSÉS
- ANIONS
- CATIONS
- HYDRURES
- SIGMA ORBITALE
- PI ORBITALE
- LIGAND ou COORDINAT, chimie
- DEGRÉ D'OXYDATION
- CLUSTER
- TRANSITION MÉTAUX DE
- MÉTALLOCÈNES
- STABILITÉ, chimie
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- FERROCÈNE
- DONNEUR, chimie
- ACCEPTEUR, chimie
- COORDINATION COMPOSÉS DE