TAXOL ET TAXOTÈRE
Hémisynthèse du taxol et découverte du taxotère
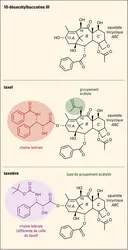
Structure chimique des molécules 10-désacétylbaccatine III, taxol et taxotère
Encyclopædia Universalis France
Au début des années 1980, malgré les propriétés anticancéreuses prometteuses du taxol, son développement a été entravé, principalement en raison des faibles quantités obtenues à partir de l'écorce du Taxus brevifolia, ce qui nécessitait l'abattage de nombreux arbres. Cette exploitation intensive de l'if inquiéta alors les mouvements écologiques qui redoutaient la disparition de cette espèce. La solution vint de l'équipe de Pierre Potier, directeur de l'Institut de chimie des substances naturelles du C.N.R.S. à Gif-sur-Yvette, dont les travaux sur la recherche de composés anticancéreux étaient soutenus par les laboratoires Rhône-Poulenc Rorer. L'idée était de rechercher un taxane facile d'accès permettant une hémisynthèse (synthèse chimique à partir de composés naturels qui possèdent déjà une partie de la structure de la molécule à synthétiser) rapide et pratique du taxol. Pierre Potier et ses collaborateurs étudièrent les feuilles (aiguilles) de l'if européen Taxus baccata présent dans le parc du C.N.R.S. En suivant l'activité sur les microtubules, ils identifièrent un composé, la 10-désacétylbaccatine III, faiblement actif mais isolé en quantités importantes à partir d'une source renouvelable : les aiguilles de l'if européen. Comme sa structure ressemble à celle du taxol, la 10-désacétylbaccatine III pouvait servir de matière première dans l'hémisynthèse du taxol. Des premiers essais de réactions chimiques (estérification puis oxyamination) entre la 10-désacétylbaccatine III et l'acide cinnamique conduisirent à la synthèse de composés intermédiaires très proches de la structure du taxol. Parmi ceux-ci, l'équipe de Pierre Potier identifia un composé, nommé taxotère, plus actif que le taxol, à partir duquel ce dernier pouvait être obtenu facilement. Comme cette hémisynthèse nécessitait l'utilisation d'un réactif toxique (le tétroxyde d'osmium), une autre méthode d'obtention du taxol, toujours utilisée aujourd'hui, fut mise au point en collaboration avec l'équipe d'Andrew Greene de l'université de Grenoble. Le problème d'approvisionnement en taxol était ainsi résolu. Le taxotère est préparé de la même façon. Après des essais précliniques et cliniques concluants, le dossier d'enregistrement du taxotère est déposé en 1994, en Europe et aux États-Unis, pour une utilisation contre le cancer du sein et du poumon.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Françoise GUÉRITTE : directrice de recherche, INSERM
Classification
Pour citer cet article
Françoise GUÉRITTE. TAXOL ET TAXOTÈRE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Voir aussi


